
 ,其中氮的化合价为-2.
,其中氮的化合价为-2.分析 (1)N2H4是氮原子和氢原子形成四个共价键,氮原子和氮原子间形成一个共价键形成的共价化合物,元素化合价代数和为0计算化合价;
(2)氨气被次氯酸钠溶液氧化生成肼,次氯酸钠被还原生成氯化钠;
(3)已知:①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
依据盖斯定律计算③×2-②×2-①可得;
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离方程式为N2H4+H2O?N2H5++OH-,平衡常数Kb=$\frac{c({N}_{2}{{H}_{5}}^{+})•c(O{H}^{-})}{c({N}_{2}{H}_{4})}$=$\frac{c({N}_{2}{{H}_{5}}^{+})•c(O{H}^{-})}{c({N}_{2}{H}_{4})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=K×Kw,由于是二元碱,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2.
解答 解:(1)肼的分子式为N2H4,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为 ;其中氢元素化合价为+1价,则氮元素化合价为-2价;
;其中氢元素化合价为+1价,则氮元素化合价为-2价;
故答案为额: ;-2;
;-2;
(2)(2)氨气被次氯酸钠溶液氧化生成肼,次氯酸钠被还原生成氯化钠,结合原子守恒配平书写反应的化学方程式为:ClO-+2NH3=N2H4+Cl-+H2O;
故答案为:ClO-+2NH3=N2H4+Cl-+H2O;
(3)已知:①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
依据盖斯定律计算③×2-②×2-①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=2△H3-2△H2-△H1;
故答案为:△H4=2△H3-2△H2-△H1;
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离方程式为N2H4+H2O?N2H5++OH-,平衡常数Kb=$\frac{c({N}_{2}{{H}_{5}}^{+})•c(O{H}^{-)}}{c({N}_{2}{H}_{4})}$=$\frac{c({N}_{2}{{H}_{5}}^{+})•c(O{H}^{-})}{c({N}_{2}{H}_{4})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=K×Kw=8.7×107×1.0×10-14=8.7×10-7,第二步电离方程式为N2H5++H2O?N2H62++OH-,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2;
故答案为:8.5×10-7;N2H6(HSO4)2.
点评 本题考查了氮及其化合物性质、物质结构、热化学方程式和盖斯定律计算应用、平衡常数的计算方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO (g)+2H2 (g)═CH3 OH(g) | △H1=-90.8kj/mol | k1=160(mol/L)-2 |
| ②CO2 (g)+H2 (g)═CO (g)+H2 O(g) | △H2=-41.2kj/mol | K2 |
| ③3H2 (g)+CO2 (g)═H2 O(g)+CH3 OH(g)△H 3 | △H3 | K3=160(mol/L)-2 |
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |
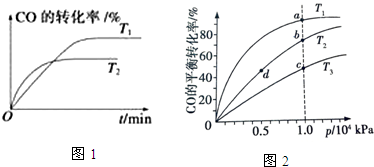
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
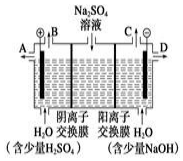
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,46g NO2和N2O4含有2NA个氧原子 | |
| B. | 1mol Na中约含NA个电子 | |
| C. | 4gNaOH中含有NA个OH- | |
| D. | 标况下,22.4LHF中含有NA个HF分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量H2与Cl2,H2的分子数比Cl2多 | |
| B. | 摩尔是用来衡量微观粒子多少的物理量 | |
| C. | 0.1molH2SO4含有氢原子数的精确值为1.204×1023 | |
| D. | 0.5mol氢的质量是0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
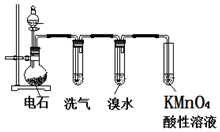 如图为实验室制取乙炔并验证其性质的装置图,回答下列问题:
如图为实验室制取乙炔并验证其性质的装置图,回答下列问题: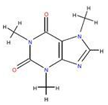 ,实验室可通过下列简单方法从茶叶中提取咖啡因:
,实验室可通过下列简单方法从茶叶中提取咖啡因: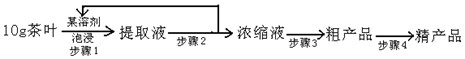
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
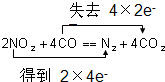
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氢氧化钠的摩尔质量是40 g | |
| C. | 1mol H2SO4中含有1mol H2 | |
| D. | 氩气的摩尔质量在数值上等于它的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ①④ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com