
分析 (1)电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得;
(2)失电子化合价升高的反应物是还原剂,根据得失电子相等计算失去电子的物质的量;
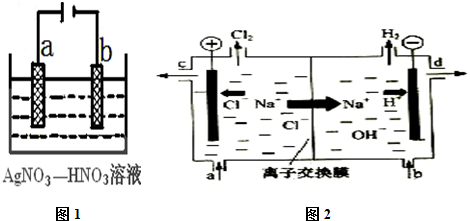
(3)电解精炼银时,粗银作阳极,若b极有少量红棕色气体生成,则b电极上硝酸根离子得电子生成二氧化氮;
(4)①电解精制饱和食盐水生成氯气、氢气、烧碱;
②阳离子交换膜只能阳离子通过,阴离子和气体不能通过;
③电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、NaOH在阴极,NaOH溶液的出口为d,Cl2在阳极,精制饱和食盐水从阳极进入.
解答 解:(1)冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物,由于AlCl3是共价化合物熔融时不导电,所以Al是电解熔融的Al2O3制得;铁和铜用热还原法,
故答案为:bd;
(2)在该反应中,Cu元素化合价由+1升高到+2,S元素由-2升高到+6,所以Cu2S做还原剂;
氧化还原反应中得失电子数相等,所以当有1molO2参与反应时失去4mol电子,则还原剂所失电子的物质的量为4mol;
故答案为:Cu2S;4;
(3)电解精炼时,粗银做阳极,所以粗银是a极;b电极是阴极,发生还原反应,生成了红棕色气体是NO2,电极反应:NO3-+e-+2H+=NO2↑+H2O,
故答案为:a;NO3-+e-+2H+=NO2↑+H2O;
(4)①电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
②阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应2NaOH+Cl2=NaCl+NaClO+H2O,生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯;
故答案为:防止阳极生成的氯气与阴极生成的氢氧化钠反应而使产品不纯;防止阳极生成的氯气与阴极生成的氢气反应遇火反应而引发安全事故;
③电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;
Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即进口为a,
故答案为:a,d.
点评 本题考查了金属的冶炼方法、氧化还原反应、电解原理等知识点,根据金属的活泼性确定冶炼方法、离子的放电顺序,注意电解原理的分析,电极分析判断方法,题目难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 伴有能量变化的物质变化,都是化学变化 | |
| B. | 干冰升华时,二氧化碳分子中的共价键不发生断裂 | |
| C. | 凡经加热而发生的化学反应都是吸热反应 | |
| D. | C(石墨,s)═C(金刚石,s),反应中既没有电子得失也没有能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰气化需要吸收大量的热,这个变化是吸收能量的化学反应 | |
| B. | 酒精可用作燃料,酒精燃烧是释放能量的反应 | |
| C. | 木炭需要加热到一定温度才能燃烧,所以木炭燃烧是吸收能量的反应 | |
| D. | 铝热反应放出大量的热(金属熔化),说明该反应常温下即可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水、次氯酸都属于弱电解质 | |
| B. | 有同种元素组成的物质一定是纯净物 | |
| C. | NaHSO4在溶液中能电离出H+,所以NaHSO4是酸 | |
| D. | 侯氏制碱法法的工艺中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时仰视液面 | |
| B. | 溶解后立即转移到容量瓶中 | |
| C. | 未洗涤烧杯和玻璃棒 | |
| D. | 溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3是碱 | B. | NaHCO3是酸 | C. | NaHCO3是盐 | D. | NaHCO3是一元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含分子个数相等 | B. | 物质的质量相等 | ||
| C. | 所含原子物质的量相等 | D. | 体积之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、 柠檬黄、日落黄、山梨酸钾等 |
| 果汁含量 | ≥80%生产日期标于包装袋封口上 |
| 实例 | 性质 |
| 紫外线消毒 | 变性 |
| 蛋白质遇浓硝酸变黄 | |
| 误食了重金属离子,可以立即喝大量的牛奶来缓解 毒性 | |
| 鸡蛋清溶液中加入少量饱和的硫酸铵溶液出现沉淀 | |
| 常用酒精清洗伤口 | |
| 蒸煮鸡蛋食用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com