
| A | B | C | D |
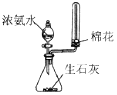 | 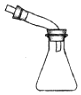 | 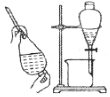 | 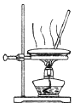 |
| 快速制备和收集一定量的氨气 | 蒸馏时的接收装置 | 用于分离C2H5OH和水混合物 | 直接蒸发氯化铁溶液获得氯化铁晶体 |
| A. | A | B. | B | C. | C | D. | D |
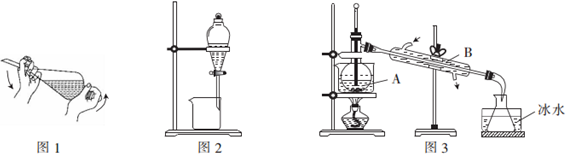
分析 A.浓氨水与CaO混合可制备氨气,氨气的密度比空气密度小;
B.接收时不需要密封;
C.C2H5OH和水混合物互溶;
D.加热促进水解,生成盐酸易挥发.
解答 解:A.浓氨水与CaO混合可制备氨气,氨气的密度比空气密度小,则图中装置可快速制备和收集一定量的氨气,故A正确;
B.接收时不需要密封,不需要塞子,故B错误;
C.C2H5OH和水混合物互溶,应选蒸馏法分离,不能分液,故C错误;
D.加热促进水解,生成盐酸易挥发,不能蒸发,应选冷却结晶法制备,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的制备、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化是物理变化 | |
| B. | 煤的干馏是在隔绝空气条件下进行的 | |
| C. | 大量燃烧煤炭是造成雾霾的重要原因 | |
| D. | 发展“煤制油”工程可减少对石油产品的依赖 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅可用于制造光导纤维 | |
| C. | 为防止富脂食品氧化变质,在包装袋中放入生石灰 | |
| D. | 钠、钾、铁等金属及其化合物能发生焰色反应,可用于制造烟花 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的Na2A溶液中,由水电离产生的c(OH-)=10a-14 | |
| B. | 将pH=a的H2A稀释为pH=a+l的过程中,c(H2A)/c(H+)减小,则H2A为弱酸 | |
| C. | 测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| D. | 0.2 mol•L-1 H2A 溶液中的 c(H+)=a,0.1 mol•L-1 H2A溶液中的 c(H+)=b,若a<2 b,则H2A为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质与M单质不能直接化合 | |
| B. | Y的合金可用作航空航天飞行器材料 | |
| C. | M简单离子半径大于Y2+的半径 | |
| D. | X和Z的气态氢化物,前者更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,Zn板应与外接电源的负极相连 | |
| B. | 放电时,溶液中的OH从正极向负极移动 | |
| C. | 正极反应式为:FeO42-+3e-+4H2O═Fe(OH)3+5OH- | |
| D. | 充电时,当转移0.2mol电子时,阴极质量增加3.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠原子的结构示意图: | |
| B. | 过氧化钠的电子式: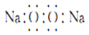 | |
| C. | 小苏打在水中的电离方程式:NaHCO3═Na++HCO3- | |
| D. | 硫化钠的水溶液呈碱性的原因:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com