
| A. | I2微溶于水,易溶于CCl4;HCl易溶于水 | |
| B. | 在水中的溶解度:C2H5OH>CH3CH2CH2CH2OH | |
| C. | 不同的烃之间相互溶解 | |
| D. | I2易溶于KI溶液中 |
分析 根据相似相溶原理知,非极性分子的溶质极易溶于非极性分子的溶剂,极性分子的溶质极易溶于极性分子的溶剂,据此分析解答.
解答 解:A.碘和四氯化碳都是非极性分子,HCl和水都是极性分子,根据相似相溶原理知,I2微溶于水,易溶于CCl4;HCl易溶于水,故A不选;
B.水是极性分子,乙醇中含有乙基,戊醇中含有戊基,乙基对羟基的影响较小,导致乙醇接近于极性分子,而戊基对羟基影响较大,使戊醇接近于非极性分子,根据相似相溶原理知,乙醇易溶于水,而戊醇较难溶于水,故B不选;
C.烃都是非极性分子,根据相似相溶原理知,不同的烃之间相互溶解,故C不选;
D.I2在KI溶液中与I-互相作用生成I3-离子,I2+I-=I3-,I3-离子在水中的溶解度很大,因此碘在KI的溶液中溶解度增大,所以不能用相似相溶原理解释,故D选;
故选D.
点评 本题考查相似相溶原理,明确其内涵是解本题关键,易错选项是D,注意碘和碘离子发生反应,注意相似相溶原理适用范围.


科目:高中化学 来源: 题型:解答题
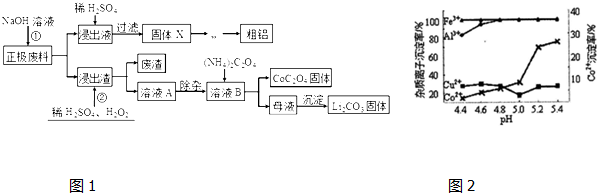
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液可为LiCl水溶液 | |
| B. | 该电池放电时,负极发生还原反应 | |
| C. | 放电时正极反应式为:2SOCl2+4e-=4Cl-+S+SO2 | |
| D. | 放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2 mol•L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气速率不变 | |
| B. | 铁和稀硫酸反应制取氢气时,改用铁片和浓硫酸可加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | ①②③ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

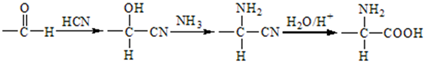
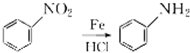
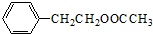 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$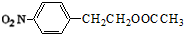 +H2O.
+H2O.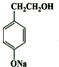 .
.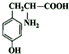 .
.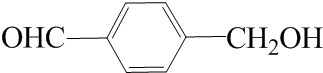 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、CO32- | B. | Na+、Ca2+、SO42-、NO3- | ||
| C. | Ag+、Mg2+、Cl-、S2- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
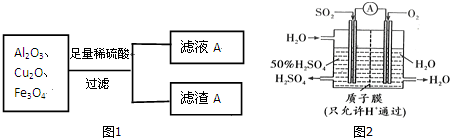
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
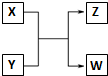 已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题:
已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com