
分析 (1)①反应6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)中,Fe元素化合价由+2价部分升高到+3价,C元素化合价由+4价降低到0价;
②6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=-76.0kJ•mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+113.4kJ•mol-1,
两热化学方程式相加除以2得:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的反应热;
(2)平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L) 1.0 4.0 0 0
变化量(mol/L) 0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
根据平衡常数为生成物浓度的幂次方之积比上反应物浓度的幂次方之积书写;比较300℃与200℃时的平衡常数K的值判断反应的△H.
解答 解:(1)①反应6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)中,Fe元素化合价由+2价部分升高到+3价,C元素化合价由+4价降低到0价,还原产物为C,每生成1mol Fe3O4,则生成0.5molC,转移2mol电子,
故答案为:C;2;
②6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=-76.0kJ•mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+113.4kJ•mol-1,
两热化学方程式相加除以2得:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)
△H=(-76.0kJ/mol+113.4kJ/mol)÷2=+18.7kJ/mol,
故答案为:+18.7kJ/mol;
(2)平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L) 1.0 4.0 0 0
变化量(mol/L) 0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
反应的平衡常数表达式K=$\frac{c({H}_{2}O){c}^{2}(C{H}_{4})}{c(C{O}_{2}){c}^{4}({H}_{2})}$=$\frac{1.{6}^{2}×0.8}{0.2×0.{8}^{4}}$=25,因为200℃时该反应的平衡常数K=64.8,所以升温K变小,平衡向逆反应方向移动,所以△H<0;
故答案为:25;<.
点评 本题考查较为综合,涉及热化学方程式定量计算,化学平衡的计算,氧化还原反应的理解应用等知识,为高考常见题型,侧重考查学习的分析、计算能力,题目难度中等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
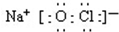 ;若将84消毒液长期露置于空气中,溶液中的主要成分最终将变为NaCl.(填化学式)
;若将84消毒液长期露置于空气中,溶液中的主要成分最终将变为NaCl.(填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
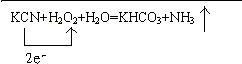 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②③ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃容器可长期盛放各种酸 | |
| B. | 水中加入明矾、硫酸铁溶液可以起净水作用 | |
| C. | Al2O3可制造耐高温的实验仪器 | |
| D. | Na2S可除去污水中有毒的Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
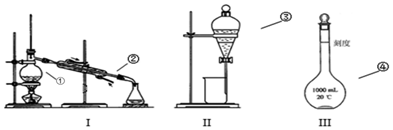
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘升华 | B. | 盐酸和氢氧化钠溶液混合 | ||
| C. | 氯化氢溶于水 | D. | 氯化氢与氨气反应生成氯化铵固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com