
分析 ①能自发进行的放热的氧化还原反应能设计成原电池;
②失电子发生氧化反应的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的电解质溶液作电解质溶液.
解答 解:①(A)NaOH+HCl=NaCl+H2O不是氧化还原反应,所以不能设计成原电池,(B)2FeCl3+Cu═2FeCl2+CuCl2是自发进行的放热的氧化还原反应,所以能设计成原电池,
故答案为:不能;能;
②在2FeCl3+Cu═2FeCl2+CuCl2反应中,FeCl3被还原,发生还原反应,为正极反应,可用碳棒作正极,电极反应为2Fe3++2e-=2Fe2+,Cu被氧化,为原电池负极反应,电极反应为Cu-2e-=Cu2+,该反应中FeCl3得电子发生还原反应,所以电解质溶液是FeCl3溶液,
故答案为:铜片;FeCl3溶液;Fe3++e-=Fe2+;还原.
点评 本题考查原电池的设计,本题难度不大,注意原电池的组成特点和反应原理,注意电极反应式的书写,为常考查知识.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
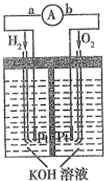 氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉(金属铂吸附气体的能力强,性质稳定).请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉(金属铂吸附气体的能力强,性质稳定).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
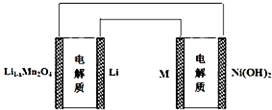
| A. | 锂离子电池放电时Li+向正极迁移 | |
| B. | 锂离子电池充电时,阴极的电极反应式:LiMn2O4-xe-═Li1-xMn2O4+xLi+ | |
| C. | 如图表示用锂离子电池给镍氢电池充电 | |
| D. | 镍氢电池放电时,负极的电极反应式:MH+OH--e-═H2O+M |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.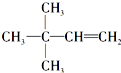 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
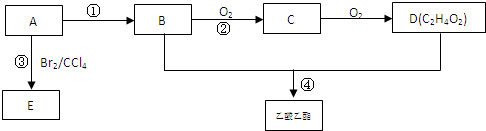
 CH3COOCH2CH3+H2O:反应类型:酯化反应.
CH3COOCH2CH3+H2O:反应类型:酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 反应物的总能量比生成物的总能量大 | |
| C. | 氢氧化钠与盐酸的反应属于吸热反应 | |
| D. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com