
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(2) ~ (3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答。
族 周期 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | F | H | I |
(1)表中元素,化学性质最不活泼的原子结构示意图是___________,非金属性最强的元素在周期表中的位置是__________________________,
(2)最高价氧化物的水化物中碱性最强的是_________,酸性最强的是___________,
(3)A分别与D、E、G形成的最简单化合物中,最不稳定的_______________,
(4)A和E组成最简单化合物的电子______________
(5)在B、C、F、G的简单离子中,离子半径由大到小的顺序是__________________,
(6)由A的单质与O2构成的燃料电池中,在E的最高价氧化物对应水化物的条件下进行,写出正极的电极反应式______________________________________。
(7)当B的最高价氧化物的水化物与C的最高价氧化物反应后,向所得溶液中通入过量D的最高价氧化物的离子方程式___________________________________,
【答案】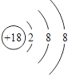 第2周期第Ⅶ A族NaOHHClO4CH4
第2周期第Ⅶ A族NaOHHClO4CH4![]() S2—>F—>Na+>Al3+O2 + 4H+ + 4e-==2H2OAlO2— + 2H2O + CO2=Al(OH)3 ↓+ HCO3—
S2—>F—>Na+>Al3+O2 + 4H+ + 4e-==2H2OAlO2— + 2H2O + CO2=Al(OH)3 ↓+ HCO3—
【解析】
根据元素周期表的结构,表中A、B、C、D、E、F、G、H、I元素分别是H、Na、Al、C、N、P、F、Cl、Ar。(1)根据元素周期律可得化学性质最不活泼的应是惰性气体Ar,非金属性最强的元素为F,故答案为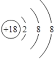 、第2周期第Ⅶ A族;(2)在表中所列元素中,金属性最强的是Na,最高价氧化物的水化物碱性最强的是NaOH;非金属性最强的是F,但是F无最高正价,则酸性最强的是应是HClO4,故答案为NaOH、H ClO4,(3)在D、E、G三种元素中非金属性最弱的为D,也是就碳元素,故它的氢化物最不稳定,故答案为CH4;(4)A和E组成的最简单的化合物为NH3,其电子式为
、第2周期第Ⅶ A族;(2)在表中所列元素中,金属性最强的是Na,最高价氧化物的水化物碱性最强的是NaOH;非金属性最强的是F,但是F无最高正价,则酸性最强的是应是HClO4,故答案为NaOH、H ClO4,(3)在D、E、G三种元素中非金属性最弱的为D,也是就碳元素,故它的氢化物最不稳定,故答案为CH4;(4)A和E组成的最简单的化合物为NH3,其电子式为![]() ;(5)B、C、F、G的简单离子分别为Na+、Al3+、S2—、F—,四种离子的最外层电子数相同,而硫离子比其余三种离子多一个电子层,半径最大,Na+、Al3+、F—三种离子的核外电子排布相同,核电荷数越大,半径反而越小,故半径的大小顺序为S2—>F—>Na+>Al3+;(6)在氢氧燃料电池中通入氧气的一极为正极,在酸性条件下的电极反应为O2 + 4H+ + 4e-==2H2O;(7)B的最高价氧化物的水化物与C的最高价氧化物反应后得到的是偏铝酸钠溶液,向其中通入过量的二氧化碳的离子方程式为AlO2— + 2H2O + CO2=Al(OH)3 ↓+ HCO3—,即得答案。
;(5)B、C、F、G的简单离子分别为Na+、Al3+、S2—、F—,四种离子的最外层电子数相同,而硫离子比其余三种离子多一个电子层,半径最大,Na+、Al3+、F—三种离子的核外电子排布相同,核电荷数越大,半径反而越小,故半径的大小顺序为S2—>F—>Na+>Al3+;(6)在氢氧燃料电池中通入氧气的一极为正极,在酸性条件下的电极反应为O2 + 4H+ + 4e-==2H2O;(7)B的最高价氧化物的水化物与C的最高价氧化物反应后得到的是偏铝酸钠溶液,向其中通入过量的二氧化碳的离子方程式为AlO2— + 2H2O + CO2=Al(OH)3 ↓+ HCO3—,即得答案。


科目:高中化学 来源: 题型:
【题目】液氨和水类似,也能电离:NH3+NH3![]() NH4++NH2-,25℃时,其离子积K=1.0×10-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L)
NH4++NH2-,25℃时,其离子积K=1.0×10-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L)
A. c(NH4+)=1.0×10-29molL-1 B. c(Na+)=c(NH2-)
C. c(NH2-)>c(NH4+) D. c(NH4+) c(NH2-)=1.0×10-30
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请在标有序号的空白处填空:以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答有关问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是(可多选)__________。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl→CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性高的是__________反应(填反应类型)。
(2)有毒物质的无害化也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性酸根离子氧化除去。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________,并说明该方法的优点_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为C6H6的结构有多种,其中的两种见图甲、乙:

①这两种结构的区别表现在定性方面(即化学性质方面):
甲能_______(填字母,下同)而乙不能_______。
A.被酸性KMnO4溶液氧化 B.与Br2的CCl4溶液发生加成反应
C.与液Br2在催化剂作用下发生取代反应 D.与H2发生加成反应
②定量方面:1mol C6H6与 H2加成时甲需要______molH2,而乙需要_____molH2。
(2)今发现 C6H6还有另一种如图立体结构: ![]() ,该结构的二氯代物有______种。
,该结构的二氯代物有______种。
(3)已知萘的结构简式为 ,下列关于萘的说法正确的是______ (填编号)。
,下列关于萘的说法正确的是______ (填编号)。
A.萘的分子式为C10H10 B.1mol萘能与6molH2发生加成反应
C.萘分子中所有原子在同一平面上 D.萘的一溴代物只有两种同分异构体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是

A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a—淀粉酶的最适温度为60℃,某同学为了探究pH对a—淀粉酶活性的影响,在35℃和45℃两个温度条件下分别设置了7支试管,每支试管中均加入4 mL淀粉溶液(淀粉的初始含量为yo g),然后加入pH缓冲液,设置pH值分别为1.0、3.0、5.0、7.0、9.0、11.0、13.0,再加入2 mL a—淀粉酶溶液,反应3 min盾迅速在每支试管中同时加入足量的NaOH溶液,测定每支试管中的淀粉的剩余量,得到如图所示的曲线。请回答下列问题:
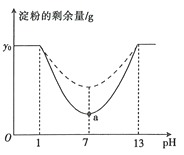
(1)反应3 min后迅速加入足量的NaOH溶液的目的是 。该同学认为反应时间过长或加入的淀粉量少都可能导致实验失败,其依据是酶的催化具有____的特点。
(2)分析图中数据可知,实线部分表示在温度为 条件下测定的结果;使a—淀粉酶完全失活的pH范围为 ;图中a点限制酶促反应速率的外界因素主要是____。
(3)若该同学在某pH条件下测定淀粉的剩余量为y1 g,则用淀粉的消耗速率表示该条件下促反应速率为 g/min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于三种气态烃甲烷、乙烷、乙烯,请回答下列问题:
(1)等质量的三种烃在相同状况下体积最大的是________。
(2)等质量的三种烃完全燃烧时消耗氧气最多的是________。
(3)等质量的三种烃完全燃烧生成二氧化碳最多的是________,生成水最多的是________。
(4)在120 ℃、1.01×105Pa条件下,与足量的氧气混合点燃,完全燃烧前后气体体积没有变化的烃是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将紫色石蕊试液滴入NaOH溶液中,溶液变蓝色,再通入氯气,溶液由蓝色先变成红色,最后颜色慢慢褪去,其原因是( )
①氯气有漂白性 ②氯气与NaOH溶液反应 ③氯气的水溶液呈酸性 ④次氯酸有漂白性 ⑤氯化钠有漂白性
A.①④B.②③④C.①②③D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到实验目的的是:
A. 用激光笔照射可区分氢氧化铁胶体与氯化铁溶液
B. 用淀粉溶液检验食盐溶液中是否存在IO3-
C. 用通入氧气点燃的方法除去CO2中的CO杂质
D. 用排水集气法收集二氧化氮气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com