
分析 (1)①酸性条件下,正极上氧气得电子和氢离子反应生成水;
②5.8kg丁烷的物质的量=$\frac{5800g}{58g/mol}$=100mol,100mol丁烷完全燃烧放出热量为2.9×105kJ,则1mol丁烷完全燃烧放出2900kJ热量;
根据盖斯定律计算放出热量;
③碱性条件下,甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
(2)盖斯定律指若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同,36g碳不完全燃烧与这些碳完全燃烧相比损失的热量为生成的一氧化碳燃烧放出的热量;根据碳原子守恒计算出一氧化碳的物质的量,再根据一氧化碳燃烧的热化学方程式计算,即可解答;
(3)根据反应热△H=反应物总键能-生成物总键能计算.
解答 解:(1)①酸性条件下,正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
②5.8kg丁烷的物质的量=$\frac{5800g}{58g/mol}$=100mol,100mol丁烷完全燃烧放出热量为2.9×105kJ,则1mol丁烷完全燃烧放出2900kJ热量,所以其热化学反应方程式为C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5 H2O(l)△H=-2900kJ•mol-1,
C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5 H2O(l)△H=-2900kJ•mol-1
H2O(l)=H2O(g)△H=+44kJ/mol
所以C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(g)△H=-2680kJ•mol-1,
故答案为:C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5 H2O(l)△H=-2900kJ•mol-1;-2680kJ•mol-1;
③碱性条件下,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH-+8e-═CO32-+7H2O,故答案为:CH4+10OH-+8e-═CO32-+7H2O;
(2)36g碳的物质的量为:n=$\frac{36g}{12g/mol}$=3mol,
不完全燃烧所得气体中,CO占三分之一体积,根据碳原子守恒,求得CO的物质的量为3mol×$\frac{1}{3}$=1mol,
根据2CO(g)+O2(g)═2CO2(g)△H=-576kJ/mol,
1molCO燃烧放出的热量为:576kJ×$\frac{1}{2}$=288kJ,
所以36g碳不完全燃烧生成1molCO损失的热量为288kJ,
故答案为:288;
(3)N2和H2为原料合成NH3的反应为N2(g)+3H2(g)?2NH3(g)△H=反应物总键能-生成物总键能=946.0kJ•mol-1+3×436.0kJ•mol-1-6×390.8kJ•mol-1=-90.8 kJ•mol-1;故答案为:N2(g)+3H2(g)?2NH3(g)△H=-90.8 kJ•mol-1.
点评 本题考查原电池原理、热化学反应,明确各个电极上发生的反应和盖斯定律的应用是解本题关键,会正确书写电极反应式,此知识点为高考高频点,熟练掌握.


科目:高中化学 来源: 题型:选择题
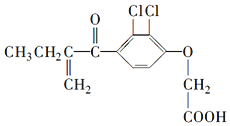
| A. | 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| B. | 利尿酸分子内处于同一平面的原子不超过10个 | |
| C. | 1mol利尿酸能与7mol H2发生加成反应 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.1mol/L的AlCl3溶液 | B. | 20mL0.2mol/L的CaCl2溶液 | ||
| C. | 30mL0.2mol/L的KCl溶液 | D. | 10mL0.25mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有电子转移(得失或偏移)的化学反应都是氧化还原反应 | |
| B. | p电子原子轨道的平均半径随电子层的增大而增大 | |
| C. | 电子是在原子核外,能量由低到高的不同电子层上分层排布的 | |
| D. | 氢原子电子云图中小黑点表示电子的运动轨迹 |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol/L NaOH溶液 | pH = 11 NaOH溶液 | 0.1 mol/L CH3COOH溶液 | pH = 3 CH3COOH溶液 |
下列说法正确的是( )
A.由水电离出H+的浓度c(H+):①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5
C.①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH)
D.将②与④等体积混合,若溶液pH<7,各离子浓度的关系为:
c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com