
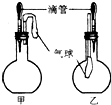
 如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则滴管和烧瓶中所用试剂不可能是( )
如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则滴管和烧瓶中所用试剂不可能是( )| 甲 | 乙 | |
| A | 水和过氧化钠 | 盐酸和NH3 |
| B | 双氧水和MnO2 | 水和NO |
| C | 盐酸和NaHCO3固体 | NaOH溶液和Cl2 |
| D | 饱和食盐水和电石 | 酸性高锰酸钾溶液和SO2 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、太阳能、地热能、核能等均属于新能源 |
| B、“低碳”是指采用含碳量低的烃类化合物作燃料 |
C、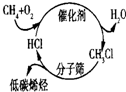 甲烷经一氯甲烷转化成低碳烯烃的途径体现了“节能减排”思想 |
| D、减少化石能源的使用能减少CO2的排放量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )
已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )| A、图中A点对应的状态表示该反应达到化学平衡 |
| B、若某温度时k1=k2,则该温度下反应的平衡常数K=0.5 |
| C、在1L密闭容器中充入1 mol NO2,平衡时:c(NO2)+c(N2O4)=1 mol?L-1 |
| D、在1L密闭容器中充入1 mol NO2,当c(NO2)=c(N2O4)时,NO2的转化率是33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
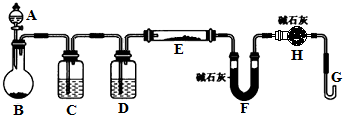 某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:| ①空E管的质量a; | ④反应前F管及内盛物的总质量d; |
| ②E管和WO3的总质量b; | ⑤反应后F管及内盛物的总质量e |
| ③反应后E管和W粉的总质量c(冷却后); |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气体 | 烧瓶和气体的总质量(g) |
| A | 48.4082 |
| B | 48.4082 |
| C | 48.4082 |
| D | 48.4342 |
| E | 48.8762 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 反应 温度/℃ | c(HCl)/ mol?L-1 | V(HCl) /mL | 10g碳酸钙的形状 | t/min |
| 1 | 20 | 2 | 10 | 块状 | t1 |
| 2 | 20 | 2 | 10 | 粉末 | t2 |
| 3 | 20 | 4 | 10 | 粉末 | t3 |
| 4 | 40 | 2 | 10 | 粉末 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com