
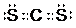 ,该分子为非极性(选填“极性”、“非极性”)分子.
,该分子为非极性(选填“极性”、“非极性”)分子.分析 (1)涉及短周期元素有Na、C、O,结合元素周期律判断;
(2)CS2结构与二氧化碳相似;
(3)锶的原子序数为38,某锶原子的质量数为88,则中子数为88-38=50;最外层有2个电子,锶的金属性比Ca强,性质活泼;
(4)反应离子方程式为SrSO4+CO32-?SrCO3+SO42-,可说明SrCO3难溶于水,平衡常数为生成物、反应物浓度幂之积的比值;
(5)升高温度,反应速率增大,如转化率降低,可说明平衡逆向移动.
解答 解:(1)涉及短周期元素有Na、C、O,原子半径最大的为Na,非金属性最强的为O,故答案为:Na;O;
(2)CS2结构与二氧化碳相似,电子式为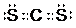
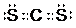
(3)锶的原子序数为38,某锶原子的质量数为88,则中子数为88-38=50,能包含这些信息的一种化学符号8838Sr,最外层电子排布式为5s2,最外层有2个电子,最高化合价为+2价,锶的金属性比Ca强,性质活泼,在自然界以化合态存在,只有bd正确,
故答案为:8838Sr;5s2; bd;
(4)反应离子方程式为SrSO4+CO32-?SrCO3+SO42-,可说明SrCO3难溶于水,平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$,
故答案为:难;$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$;
(5)升高温度,反应速率增大,如转化率降低,可说明平衡逆向移动,则正反应为放热反应,故答案为:增大;放热.
点评 本题考查较为综合,既考查元素周期表、元素周期律知识,又考查沉淀转化,为高考常见题型和高频考点,侧重考查学生的分析能力,难度中等.


科目:高中化学 来源: 题型:填空题
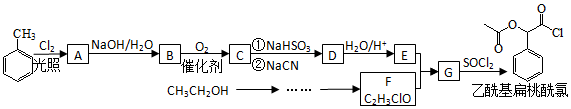
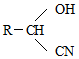 ;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、SO42-、Cl- | B. | Al3+、NO3-、Cl- | C. | K+、Fe3+、SO42- | D. | Na+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
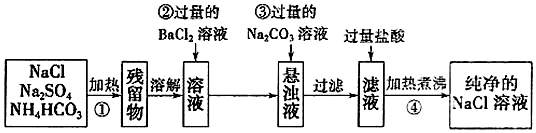
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1) | c(NaOH)/mol•L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |
| A. | 甲中:若a=7,则HA是强酸 | |
| B. | 乙中:若b≠0.2,则c(A-)=C(Na+) | |
| C. | 丙中:若HA是弱酸,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$<1 | |
| D. | 丁中:若 c=9,则c(OH-)-c(HA)=10-9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 化合物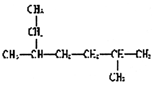 的名称为2-甲基-5-乙基己烷 的名称为2-甲基-5-乙基己烷 | |
| C. | 纤维素和油脂都是能发生水解反应的高分子化合物 | |
| D. | 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+CuSO4═FeSO4+Cu | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | NaOH+HCl═NaCl+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com