
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 | 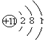 | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
 .
.分析 (1)由甲的原子结构可知,为Na,位于第三周期IA族;乙位于第三周期ⅦA族,则为Cl;丙为O,位于第二周期第ⅥA族;
(2)氧化钠为碱性氧化物,与水反应生成NaOH;乙元素对应的最高价氧化物的水化物为高氯酸;
(3)甲与乙两元素的单质反应生成物为NaCl;
(4)甲单质与丙的氢化物(水)反应生成NaOH和氢气.
解答 解:(1)由甲的原子结构可知,为Na,位于第三周期IA族;乙位于第三周期ⅦA族,则为Cl,原子结构示意图为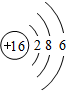 ;丙为O,位于第二周期第ⅥA族,原子结构示意图为
;丙为O,位于第二周期第ⅥA族,原子结构示意图为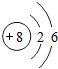 ,
,
故答案为:
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | Na | Cl | O |
| 原子结构 示意图 | 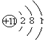 | 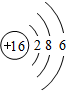 | 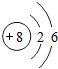 |
| 周期 | 三 | 三 | 二 |
| 族 | ⅠA | ⅦA | ⅥA |
 ,故答案为:
,故答案为: ;
;点评 本题考查元素周期表及周期律的综合应用,为高频考点,把握原子结构、元素的位置及性质为解答的关键,注意化学用语的规范使用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
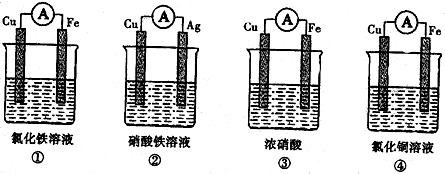
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol K2SO4溶于水,所得溶液中K+的数目为NA | |
| B. | 常温常压下,32g氧气所含分子的数目为NA | |
| C. | 标准状况下,22.4LH2O含有氢原子的数目为2 NA | |
| D. | 11.2L H2含有氢原子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL | B. | 200 mL | C. | 250 mL | D. | 280 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④ | C. | ②③⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )
如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )| ①Cu为阳极,Zn为阴极 ②Cu极上有气泡产生 ③SO42-向Cu极移动 ④若有0.5mol电子流经导线,可产生0.25mol气体 ⑤电子的流向是Cu→导线→Zn ⑥正极反应式:Cu+2e-═Cu2+ |
| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com