
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
分析 A.离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
B.元素的非金属性越强,其简单阴离子的还原性越弱;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.同一主族元素,元素的金属性随着原子序数增大而增强,同一周期元素,元素的金属性随着原子序数增大而减弱.
解答 解:A.离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以S2->Cl->K+>Al3+,故A错误;
B.元素的非金属性越强,其简单阴离子的还原性越弱,非金属性Cl>Br>I>S,所以离子的还原性:S2->I->Br->Cl-,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>C,所以酸性:HClO4>H2SO4>H3PO4>H2CO3,但HClO是弱酸,所以这四种酸强弱顺序是H2SO4>H3PO4>H2CO3>HClO,故C错误;
D.同一主族元素,元素的金属性随着原子序数增大而增强,同一周期元素,元素的金属性随着原子序数增大而减弱,所以金属性K>Ca>Mg>Br,故D正确;
故选D.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构和元素周期律关系是解本题关键,熟练掌握并灵活运用元素周期律,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Cu.Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.4NA | |
| B. | 18 g D2O中含有的质子数目为10NA | |
| C. | 1 mol Cl2发生反应时,转移的电子数一定是2 NA | |
| D. | 常温常压下,16 g O3所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
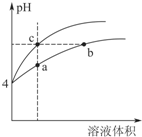 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1| 实验编号 | 氢氧化钠溶液的浓度 (mol•L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23.88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:K+、MnO4+、SO42-Cl- | |
| B. | 能使甲基橙显红色的溶液:Fe2+,NO3-,Na+,SO42- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=l0-12的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 酸性透明溶液中:Cu2+、Al3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
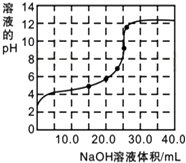 某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
某研究性学习小组探究醋酸的溶液情况,进行了如下实验.| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子半径X>Y>Z | |
| B. | 元素原子得电子能力X>Y>Z | |
| C. | 最高价氧化物对应水化物的酸性强弱X>Y>Z | |
| D. | 单质与氢气反应,X、Y、Z难度依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(Na+)=c(F-) | D. | 无法确定c(Na+)和c(F-)的大小关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431kJ | B. | 945.6kJ | C. | 649kJ | D. | 869kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com