
下列叙述中,正确的是( )
A.同主族金属的原子半径越大,熔点越高
B.稀有气体原子序数越大,沸点越低
C.分子间作用力越弱,该物质的熔点越低
D.同周期元素的原子半径越小,越易失去电子
科目:高中化学 来源: 题型:
从同一瓶盐酸溶液中取任意体积时,下列物理量不随所取体积的多少而变化的是
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
A和甲是来自石油和煤的两种基本化工原料。A是气态烃,甲是液态烃。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图所示。

(1)A分子的电子式是________;D中官能团名称是________。
(2)在反应①~⑥中,属于加成反应的是________;属于取代反应的是________(填序号)。
(3)B和D反应进行比较缓慢,提高该反应速率的方法
________________________________________________________________________
________________________________________________________________________(填一种即可)
用于鉴别B、D和甲的一种试剂是________。
(4)写出下列反应的化学方程式:
G―→B+E:___________________________________________________;
A―→F:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,其反应式为:C+2H2SO4(浓)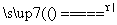 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
填写下面空白:
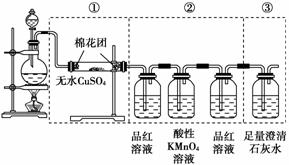
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是________;不能检出的物质是____________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是________。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是________;不能检出的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.同周期元素的原子半径以ⅦA族的为最大
B. 同主族两种元素原子的核外电子数的差值可能为26
C. 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D. 科学家在周期表中金属元素与非金属元素分界线处找到了优良的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第ⅤA族,甲和丙位于同一主族,丁原子的最外层电子数与电子层数相等。下列判断正确的是( )
A.原子半径:丙>乙>丁
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4nA个电子
B.1 L 0.1 mol·L-1的氨水中有nA个NH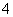
C.标准状况下,22.4 L盐酸含有nA个HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件中,两种气体所含原子数一定相等的是 ( )
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、同密度的C2H6和NO
D.同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO和H2合成CH3OH:CO(g)+2H2(g)  CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
下列说法正确的是
A.该反应的△H > 0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用5 ×103 kPa和250℃的条件,其原因是原料气的转化率高
D. t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,
则该温度时反应的平衡常数的数值为100
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com