
(14分)某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母) 。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 | | | | | | |
序号 | a | b | c | d | e | f |
(3)下列情况会使所配溶液浓度偏低的是(填序号)
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
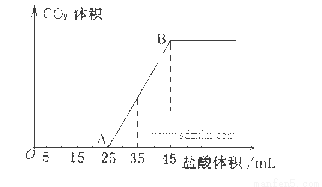
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为__________mL;
②计算所取氢氧化钠溶液的体积V=__________mL。
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为__________________________________,逐渐向反应后的溶液中至少加入1.0 mol L-1的盐酸________ mL才能使生成的沉淀完全溶解。
L-1的盐酸________ mL才能使生成的沉淀完全溶解。
(每空2分,共14分)(1)2.0
(2)a、b、e
(3)①③⑤⑥
(4)224 450
(5)2Al+2NaOH+2H2O=2NaAlO2+3H2 ; 80
; 80
【解析】
试题分析:(1)使用475mL NaOH溶液,需配制500mL的氢氧化钠溶液,则NaOH的质量是0.5L×0.10mol/L×40g/mol=2.0g;
(2)取用氢氧化钠固体需要药匙;氢氧化钠易腐蚀,所以需放在小烧杯中称量,称量需要托盘天平,所以选择abe;
(3)①称量时,左盘高,右盘低,说明砝码中固体轻,则氢氧化钠的质量偏小,浓度偏低;②固体溶解后未冷却到室温就直接转移到容量瓶中,氢氧化钠溶于水是放热的,温度高时定容会导致冷却至室温时溶液的体积减少,则溶液的浓度偏高;③溶液转移到容量瓶后,未进行洗涤操作,则溶液中溶质减少,浓度偏低;④转移溶液前容量瓶内有少量蒸馏水,因为在配制过程中需加入蒸馏水,所以容量瓶内有少量蒸馏水对结果无影响;⑤定容时,仰视容量瓶的刻度线,会导致所配溶液的体积偏大,浓度偏低;⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,会导致溶液的体积偏大,浓度偏低,所以答案选①③⑤⑥;
(4)根据所给图像判断,二氧化碳与氢氧化钠溶液反应生成碳酸钠,同时溶液中有氢氧化钠剩余,因为HCl与碳酸钠反应生成碳酸氢钠消耗的HCl的物质的量和HCl与碳酸氢钠反应生成二氧化碳消耗的HCl的物质的量是相等的关系,由图像可知生成二氧化碳消耗HCl的体积是(45-25)=20mL,而产生气体前消耗的HCl溶液的体积是25mL,说明溶液中存在未反应的NaOH。
①当加入35.0mL盐酸溶液时,实际与碳酸氢钠反应的盐酸的体积只有35-25=10mL,所以产生标准状况下二氧化碳的体积为0.01L×1mol/L×22.4L/mol=0.224L=224mL;
②根据Na元素守恒,当反应完全时所得溶液为氯化钠溶液,则n(NaOH)=n(HCl)=0.045L×1mol/L=0.045mol,该氢氧化钠的浓度是0.10mol/L,所以NaOH溶液的体积V=0.045mol/0.10mol/L=0.45L=450mL;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2 ;
;
200mL氢氧化钠的物质的量是0.2L×0.10mol/L=0.02mol,则Al的物质的量也是0.02mol,当生成的沉淀全部溶解时,此时的溶液是氯化钠与氯化铝的混合液,根据Cl元素守恒,n(HCl)=n(NaCl)+3n(AlCl3)=0.02+0.02×3=0.08mol,则需要1mol/L的盐酸的体积是0.08mol/1mol/L=0.08L=80mL。
考点:考查溶液的配制,仪器的选择,误差分析,物质质量的计算,图像的分析,元素守恒法在计算中的应用


科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下列实验中所选用的仪器或实验基本操作合理的是
①用50 mL量筒量取5.2 mL稀硫酸; ②用酒精洗涤粘有硫粉的试管;
③用托盘天平称量10.1 g氯化钠晶体; ④用饱和NaHCO3溶液除之CO2中的少量SO2;
⑤用瓷坩埚熔融NaOH固体; ⑥实验中不慎将手指划破,可立即用FeCl3溶液止血
A.①②③④ B.③④⑥
C.③④⑤ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:选择题
在化学中有很多规律,下列对规律的应用正确的是
A.根据较强酸可制取较弱酸的规律,可向次氯酸钠溶液中通入二氧化碳制取次氯酸
B.根据金属与盐溶液混合发生置换反应的规律,可用钠置换出硫酸铜溶液中的铜
C.根据酸性氧化物不与酸反应的规律,可用二氧化硅制成的容器盛放氢氟酸
D.根据电荷守恒规律,可判断溶液中所含阳离子数目一定等于阴离子数目
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三期中考试化学试卷(解析版) 题型:选择题
下列各组物质的性质比较中不正确的是
A.氧化性:F2>C12>Br2
B.酸性:HClO4>H2SO4>H3PO4
C.碱性:NaOH>Mg(OH)2>Al(OH)3
D.热稳定性:SiH4>PH3>H2S
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三期中考试化学试卷(解析版) 题型:选择题
化学与生产、生活、环境密切相关。下列说法错误的是
A.航天飞机上的隔热陶瓷瓦属于复合材料
B.水泥、陶瓷均为硅酸盐产品
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D.化学反应能够制造出新的物质,同时也能制造出新的元素
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:选择题
对于4℃时100mL水中溶解了22.4 L HCl气体(标准状况下测得)后形成的溶液,下列说法中正确的是
A.该溶液物质的量浓度为10moL/L
B.所得的溶液的体积为22.5L
C.根据题干数据,该溶液物质的量浓度无法求得
D.该溶液中溶质的质量分数因溶液的密度未知而无法求得
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A. 亚硫酸钠溶液加入稀硝酸:SO32-+2H+= SO2↑+H2O
B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次模拟考试试卷(解析版) 题型:选择题
分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是
①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质
A.②④ B.②③④ C.①③⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源:2015届山东省乐陵市高三10月初检测化学试卷(解析版) 题型:选择题
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ | 陈述Ⅲ |
A | 加压有利于提高SO2的转化率 | 工业生产硫酸常在高温下进行 | Ⅰ对,Ⅱ对;有 |
B | Cl2和SO2混合后可用来漂白纸浆 | Cl2和SO2都有较好的漂白作用 | Ⅰ对,Ⅱ错;无 |
C | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | Ⅰ对,Ⅱ对;有 |
D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对,Ⅱ对;有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com