
(07年天津卷)25 ℃时,水的电离达到平衡:H2O ![]() H+ + OH- ;ΔH > 0 ,下列叙述正确的是()
H+ + OH- ;ΔH > 0 ,下列叙述正确的是()
A.向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
答案:B
解析:水的电离是吸热反应,所以升温可促使水的电离平衡向正方向移动。而酸碱可抑制水的电离,弱电解质的离子可促进水的电离。A项中加入稀氨水,平衡逆向移动,但c(OH-)增大,A项错误。硫酸氢钠在水溶液中可完全电离产生H+,所以c(H+)增大,温度不变则KW不变。C项中的CH3COO-可促进水的电离平衡应向正方向移动,故C项错误。D项中将水加热,水的电离程度增大,KW增大,c(H+)与c(OH-)同等程度增大,PH减小,D项错误。
高考考点:本题考查了水的电离平衡与外界条件的关系。
易错提醒:Kw是一个常数,只与温度有关,易错选D;
备考提示:化学平衡、电离平衡、水解平衡是高考的热点,要理解和应用勒夏特列原理来解决此类问题。


科目:高中化学 来源: 题型:
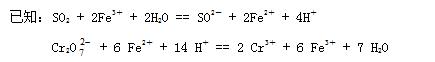
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:______________________________________________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com