
分析 (1)化学平衡常数指在一定温度下,可逆反应都达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体、纯液体不需要表示出;该反应正反应是吸热反应,温度升高平衡向正反应方向移动,据此判断;
(2)计算此时的浓度商Qc,与平衡常数比较判断反应进行方向;
(3)增加炼铁高炉的高度不影响化学平衡移动.
解答 解:(1)可逆反应Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)的平衡常数表达式k=$\frac{[C{O}_{2}]^{3}}{[CO]^{3}}$;该反应正反应是放热反应,温度降低平衡向正反应方向移动,CO2的物质的量增大、CO的物质的量减小,故到达新平衡是CO2与CO的体积之比增大,
故答案为:增大;
(2))1100℃时,K=0.263,当C(CO2)=0.025mol/L,c(CO)=0.1mol/L时,Q=$\frac{0.025}{0.1}$=0.25<0.263,该反应不处于化学平衡状态,因温度不变,K值不变,为了增大$\frac{c(C{O}_{2})}{c(CO)}$的值,反应正向进行,所以v正>v逆,
故答案为:否;大于;因温度不变,K值不变,为了增大$\frac{c(C{O}_{2})}{c(CO)}$的值,反应正向进行,所以v正>v逆;
(3)增加炼铁高炉的高度不影响化学平衡移动,Fe2O3转化率不变,
A.存在平衡,CO不可能为零,故A错误;
B.反应达到平衡状态后,Fe2O3与 CO接触会继续反应,不过V正=V逆,化学平衡不移动,故B错误;
C.可逆反应,一定条件下达到平衡状态,也就达到了反应的限度,增加炼铁高炉的高度不影响化学平衡移动,故C正确.
故答案为:C.
点评 本题考查化学平衡常数的书写与运用、化学平衡影响因素等,侧重对基础知识的巩固与运用,注意掌握化学平衡常数的书写与影响平衡移动的因素,题目难度中等.


科目:高中化学 来源: 题型:解答题
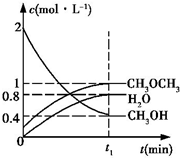 二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1
二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4粉末可用作钡餐,是因为BaSO4为非电解质 | |
| B. | 有机物苯、乙醇、蔗糖都属于非电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 固态共价化合物不导电,熔融态的共价化合物都可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和NaCl溶液中1:1通入NH3和CO2制备NaHCO3 | |
| B. | 500℃左右比常况下更有利于合成氨 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| B. | 原电池工作时负极质量一定减少 | |
| C. | 红热的铁与水蒸气反应生成氧化铁和氢气 | |
| D. | 石油的分馏属于物理变化,煤的干馏属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | H2O $\frac{\underline{\;通电\;}}{\;}$ H2↑+O2↑ | D. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1mol/L | C. | 1.5mol/L | D. | 2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2═Ba2++2OH- | B. | NaHSO4═H++Na++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | NaHCO3═H++Na++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com