
����Ŀ��2019��ŵ������ѧ������������ӵ�ؿ�������λ��ѧ�ҡ�һ������ӵ�صĽṹ��ͼ��ʾ����ط�ӦʽΪ LixC6 + Li1-xCoO2![]() C6+LiCoO2(x<1)������˵����ȷ���ǣ� ��
C6+LiCoO2(x<1)������˵����ȷ���ǣ� ��

A.���ʱ a �������Դ�ĸ���
B.�ŵ�ʱLi+�ڵ��������b����a��Ǩ��
C.���ʱ��ת��0.02 mol���ӣ�ʯī�缫������0.14 g
D.�÷Ͼɵ�ؽ������ŵ紦�������������ʯī������
���𰸡�B
��������
�ŵ�ʱ�ķ�ӦΪLi1-xCoO2+LixC6�TLiCoO2+C6��LixC6(�ɿ��ɵ���﮺�̼)Ϊ������Li�Ļ��ϼ����߱��Li+����Li1-xCoO2Ϊ������CoԪ�صĻ��ϼ۽��ͣ�CoԪ�ص�ԭ�ӵõ����ӣ�ԭ����и�������������Ӧ������������ԭ��Ӧ��������Ƿŵ������̡�
A. �ŵ�ʱa��(Li1-xCoO2)Ϊ�����õ����ӣ����������̣�a��Ӧʧȥ���������ص���������������ӵ�Դ��������A����
B. �ŵ�ʱ��ʯī��(b��)LixC6ʧȥ����Ϊ��������Li1-xCoO2(a��)Ϊ��������ԭ�����������������������Li+�ڵ��������b����a��Ǩ�ƣ�B��ȷ��
C. ���ʱ��ʯī(C6)�缫���LixC6���缫��ӦʽΪ��xLi++C6+xe-�TLixC6����ʯī(C6)�缫���ص��������Dzμӷ�Ӧ������ӵ����������ݹ�ϵʽ��xLi+ �� xe- ��֪����ת��0.02mole-����Ӧ�������Ϊ0.02molLi+��������0.14g��C����
D. �ŵ�ʱ����ص�������ӦΪ��Li1-xCoO2+xLi++xe-�TLiCoO2 ��������ӦΪLixC6-xe-�TxLi++C6���÷Ͼɵ�ؽ������ŵ紦�������������LiCoO2�����գ�D����
��ΪB��


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȳ��������ϩ��ҵ�е���Ҫ���Ʒ�Ӧ��������һ��Ӧ���Խ���ϩ��Ʒ�е���Ȳ�������ͣ��Ա��������ϩ�ۺϴ������ж�����ҵ�ϳ�Ϊ̼��������̡�
��֪��I. ![]()
![]() ��
��
II. ![]()
![]() ��
��
�ش��������⣺
(1)��֪���ֻ�ѧ���ļ��������ʾ��
��ѧ�� |
|
|
|
|
����/ | 436 | 413.4 | 615 | 812 |
![]() =____________
=____________![]() ��
��
(2)400Kʱ�����ܱ������н������ʵ�����![]() ��
��![]() ��ϣ������ʵ��Ĵ������з�Ӧ������
��ϣ������ʵ��Ĵ������з�Ӧ������![]() ���ﵽƽ��ʱ���
���ﵽƽ��ʱ���![]() ����ƽ��ʱ
����ƽ��ʱ![]() _____
_____![]() ��
��
(3)��ǰ���о�������Ȳ��![]() �Ŵر�������ⷴӦ�IJ���������ͼ��ʾ������������
�Ŵر�������ⷴӦ�IJ���������ͼ��ʾ������������![]() �����ϵ�������*��ע��
�����ϵ�������*��ע��

�Ʋ���ϩ��![]() �����ϵ�����Ϊ__________(��������������������)���̡�ͼ���������������(���)E��=______
�����ϵ�����Ϊ__________(��������������������)���̡�ͼ���������������(���)E��=______![]() ���ò���Ļ�ѧ����ʽΪ___________��
���ò���Ļ�ѧ����ʽΪ___________��
(4)![]() ʱ���������Ϊ1:2��
ʱ���������Ϊ1:2��![]() ��
��![]() ��������ܱ������У��������������Ӧ����ʼ��ϵ��ѹǿΪ
��������ܱ������У��������������Ӧ����ʼ��ϵ��ѹǿΪ![]() ��ʵ����
��ʵ����![]() �ķ�ѹ
�ķ�ѹ![]() �뷴Ӧʱ��
�뷴Ӧʱ��![]() �Ĺ�ϵ��ͼ��ʾ��
�Ĺ�ϵ��ͼ��ʾ��

��![]() ʱ��
ʱ��![]() �ڣ�ƽ����Ӧ����
�ڣ�ƽ����Ӧ����![]() ______
______![]() (�ú�
(�ú�![]() �Ĵ���ʽ��ʾ����ͬ)��
�Ĵ���ʽ��ʾ����ͬ)��
��![]() ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��
ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��![]() _____
_____![]() (
(![]() Ϊ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ=��ѹ�����ʵ�������)��
Ϊ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ=��ѹ�����ʵ�������)��
��![]() ʱ��
ʱ��![]() �ڣ�
�ڣ�![]() �ļ�С��______(����������������������)
�ļ�С��______(����������������������) ![]() ��
��![]() �ļ�С��������Ϊ__________��
�ļ�С��������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ��ʵ������Ļ�ѧ������ȷ����
A. �����ữ��KI������Һ���ú������4I��+O2 + 4H+ ![]() 2I2+2H2O
2I2+2H2O
B. ����ϡ���ᷴӦ�Ƶ�dz��ɫ��Һ��Fe + 4H+ + NO3��![]() Fe3+ + NO��+ 2H2O
Fe3+ + NO��+ 2H2O
C. ˮ���ϵ���CH3COOH��Һ�����ݲ�����CaCO3+2H+ ![]() Ca2++CO2��+ H2O
Ca2++CO2��+ H2O
D. SO2ͨ��Ư����Һ�в�����ɫ���ǣ�SO2+Ca2++2ClO-+H2O ![]() CaSO3��+2HClO
CaSO3��+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ������Ni�����̣�Mn�����仯���ﳣ������ҵ�����Ĵ�������֪Ni��OH��2������ɫ����Mn��OH��2����ɫ����������ˮ��Ksp[Ni��OH��2]=6��1018��Ksp[Mn��OH��2]=2��1013���ش��������⣺
��1��ij��Һ�к���Ũ�Ƚϴ��Ni2+��Mn2+�������еμ�NaOH��Һ����Ni2+ǡ�ó�����ȫ��ǡ����ȫ����ʱNi2+Ũ�ȵ���1.0��105mol��L1��ʱ����Һ�е�c��H+��=_______mol/L����ʱ��Һ��c��Mn2+��=_______mol/L����ʾ��![]() ����
����
��2��Ѫ�쵰�ף�Hb����O2��CO��������ƽ�⣺Hb��aq��+O2��g��![]() HbO2��aq��K1��Hb��aq��+CO��g��
HbO2��aq��K1��Hb��aq��+CO��g��![]() HbCO��aq��K2������������Ѫ�쵰������������Ľ�϶ȣ�������ע����
HbCO��aq��K2������������Ѫ�쵰������������Ľ�϶ȣ�������ע����![]() ��������������ƽ���ѹ�ı仯��ϵ����ͼ��ʾ��
��������������ƽ���ѹ�ı仯��ϵ����ͼ��ʾ��
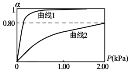
����ƽ�ⳣ��K1ԶС��K2������ͼ������1������������_______������ͼ���������ݼ�������2������ƽ���ƽ�ⳣ��_______���������ƽ���ѹ���������ƽ��Ũ�ȣ�
��CO��Ni�ܷ�����Ӧ�������ʻ�����Ni��4CO![]() Ni��CO��4�����ʻ���������֪���ʻ������¶ȸߵ��������ֽ⣬��÷�Ӧ������Ӧ��_______���������ȷ�Ӧ���������ȷ�Ӧ���������ʻ�����������ѪҺ��������ͷų����������Ӷ�ʹ�����ж����������е�ԭ��_______��
Ni��CO��4�����ʻ���������֪���ʻ������¶ȸߵ��������ֽ⣬��÷�Ӧ������Ӧ��_______���������ȷ�Ӧ���������ȷ�Ӧ���������ʻ�����������ѪҺ��������ͷų����������Ӷ�ʹ�����ж����������е�ԭ��_______��
��3����֪Ni��OH��3������ˮ��������Ni��OH��2��NaClO��Һ��Ӧ�õ�����д���÷�Ӧ�����ӷ���ʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�����������ʣ�ά����A��ά����C����Ԫ�ء���Ԫ�ء����ۡ���֬����ѡ����ȷ��������Ӧ�Ŀո��
������ȱ��ij��ά���ػ�����Ѫ��������ά������________��
������ȱ��ij����Ԫ�ػᷢ��ƶѪ��������Ԫ����________��
�ۼ���Ϊ�����ṩ�����������ṩ����֬�����������________��
(2)��������Ҫ��ѭ����������������Դ����ԭ��Ŀǰ���õķ�����________��________��________�����ַ����������ס�
(3)�����ڳ�ʪ�Ŀ�����ܿ�ͱ���ʴ��ԭ�����ڸ����ı����γ���һ��������Һ�ı�Ĥ���������������������̼��������С��ԭ��أ���д��������������Ҫ�ĵ缫��Ӧʽ������________����________��
(4)��ʳ�е���������������ת���������Ƕ������գ�һ���������������ڱ������ֽ⣬�ͷų���������д���÷�Ӧ�Ļ�ѧ����ʽ��________�������Ǿ��л�ԭ�ԣ�����������Һ����������Ӧ������������ҺʱӦ��2%ϡ��ˮ��μ���1 mL2%AgNO3��Һ�У���________Ϊֹ���ټ���1 mL10%��������Һ����ˮԡ����3��5min���۲쵽���������ɣ���д����������Ӧ�Ļ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ�����ᣨHCOOH���ͼ����ƵĻ����Һ��HCOOH��HCOO-��Ũ�ȴ��ڹ�ϵʽc(HCOO-)+c(HCOOH)=0.100 mol/L����̼Ԫ�ص����ӵ�Ũ����pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. 298Kʱ��������ˮϡ��P����Һ����Һ��n(H+)��n(OH-)���ֲ���
B. 0.1 mol/L HCOONa��Һ����c(HCOO-)+c(OH-)=c(H+)+c(HCOOH)
C. 298Kʱ��HCOOH�ĵ��볣��Ka=1.0��10-3.75
D. 0.1 mol/L HCOONa��Һ��0.1 mol/L HCOOH��Һ�������Ϻ���Һ��pH=3.75����Ϻ���Һ����仯���Բ��ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�����������M�Է��ѻ�ù���нϺõ��־����ԣ���ϳ�·������ͼ��ʾ��

��֪��
![]()
�ش��������⣺
��1��������C�еĺ���������Ϊ____________����Ӧ�ܵķ�Ӧ����Ϊ____________��
��2��д��E�Ľṹ��ʽ��________________________��
��3��д����Ӧ�ڵĻ�ѧ����ʽ��_____________________________________________��
��4��д��������C��������������һ��ͬ���칹��Ľṹ��ʽ��_________________��
�� �������ṹ�����ڼ��������·���ˮ�⣻
�� ����FeCl3������ɫ��Ӧ��
�� �����к���4�ֲ�ͬ��ѧ�������⡣
��5����֪CH3CH2CN![]() CH3CH2COOH������
CH3CH2COOH������ ��CH2==CHCN���Ҵ�Ϊԭ�Ϻϳɻ�����
��CH2==CHCN���Ҵ�Ϊԭ�Ϻϳɻ����� ![]() ��д���Ʊ��ĺϳ�·������ͼ(���Լ�����)_____��
��д���Ʊ��ĺϳ�·������ͼ(���Լ�����)_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
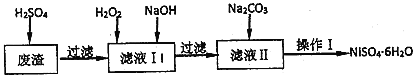
����Ŀ��NiSO46H2O��һ����ɫ������ˮ�ľ��壬�㷺���ڻ�ѧ������������صȣ����ɵ�Ʒ�Һ(�������⣬������Cu��Fe��Cr������)Ϊԭ�ϻ�á�����������ͼ��
��֪�� 25��ʱ�����ֽ�������������ܶȻ���������ȫ������pH��Χ���±���ʾ��
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0��10-16 | 4.0��10-38 | 6.0��10-31 | 6.5��10-18 |
��ȫ����pH | ��9.6 | ��3.2 | ��5.6 | ��8.4 |
ע��NiCO3��һ�ֲ�����ˮ������ǿ��ij�����
��ش��������⣺
(1)���д�ʩ���У�������߷��������ʵ���________��
A.���߷�Ӧ�¶� B.����ѹǿ C.�ڷ�Ӧ�����в��Ͻ���
(2)����ҺI�м���6%��H2O2����������__________(�����ӷ���ʽ��ʾ)������NaOH����pH�ķ�Χ��_________��Ϊ�˳�ȥ��Һ�е�_________���ӡ�
(3)����Ni2+����ȫ������ʵ�鷽����_________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com