
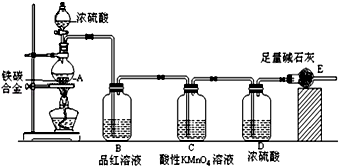
分析 由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.装置A:碳和浓硫酸反应,装置B:检验二氧化硫,装置C:除去二氧化硫,装置D:干燥二氧化碳,装置E:吸收二氧化碳.
(1)常温下碳与浓硫酸不反应,铁在浓硫酸中发生钝化现象;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水;
(3)A中生成的气体含有CO2、SO2,SO2具有漂白性,能使品红溶液褪色;
二氧化硫存在会影响二氧化碳的质量测定,C装置的作用为除尽反应产物中的SO2气体;
(4)E增重b g为二氧化碳的质量,根据碳元素守恒计算合金中碳元素的质量,合金的质量减去碳元素质量等于铁的质量,再根据质量分数定义计算.
解答 解:装置A:碳和浓硫酸反应,装置B:检验二氧化硫,装置C:除去二氧化硫,装置D:干燥二氧化碳,装置E:吸收二氧化碳.
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象,
故答案为:常温下Fe遇浓硫酸发生钝化;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;C装置的作用为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
故答案为:品红溶液褪色;除尽反应产物中的SO2气体;
(4)E增重bg为二氧化碳的质量,根据碳元素守恒可知合金中碳元素的质量为 $\frac{12}{44}$bg,合金中铁的质量为mg-$\frac{12}{44}$bg=(m-$\frac{3}{11}$b)g,故铁的质量分数 $\frac{m-\frac{3}{11}b}{m}$×100%=$\frac{11m-3b}{11m}$×100%,
故答案为:$\frac{11m-3b}{11m}$×100%.
点评 本题考查铁碳合金中铁的质量分数实验、化学计算等,清楚实验原理、掌握碳、硫、铁及其化合物性质是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,题目难度中等.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:选择题
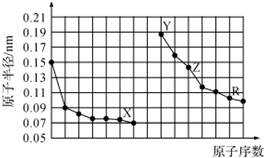
| A. | X、Y分别是O、Na元素 | |
| B. | R的单质与足量X2反应生成RX3 | |
| C. | Z的氧化物熔点很高,是较好的耐火材料 | |
| D. | 电解熔融的Z的氧化物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z | M |
| A | H2S | S | SO3 | O2 |
| B | Mg | C | CO | CO2 |
| C | NaOH | Na2CO3 | NaHCO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃分子中,所有的化学键都是单键 | |
| B. | 烷烃在光照条件下都能与氯气发生取代反应 | |
| C. | 烷烃的分子通式为CnH2n+2,符合通式的烃不一定是烷烃 | |
| D. | 随着碳原子数的增加,烷烃的熔沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑤⑦⑨ | D. | ③⑥⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com