

| A. | 装置中铜是负极 | |
| B. | 铜表面的反应为:2H++2e-=H2↑ | |
| C. | 电流的方向是从铁经导线流向铜 | |
| D. | 构成原电池后,铁与硫酸铜的反应速率加快 |
分析 铁铜原电池依据装置图分析,铁做负极失电子发生氧化反应生成二价铁离子,铜做正极,溶液中铜离子得到电子生成铜,发生还原反应,电流的方向从正极沿导线流向负极,构成原电池后,铁与硫酸铜的反应速率加快,以此解答该题.
解答 解:A.铁比铜活泼,应为原电池的负极,故A错误;
B.铜作正极,溶液中铜离子得到电子生成铜,反应为:Cu2++2e-=Cu,故B错误;
C.电流的方向从正极铜沿导线流向负极铁,故C错误;
D.该装置属于原电池,构成原电池后,铁与硫酸铜的反应速率加快,故D正确.
故选D.
点评 本题考查学生原电池的工作原理,为高频考点,侧重于双基的考查,注意把握正负极的判断及电流的流向,题目难度不大.


科目:高中化学 来源: 题型:解答题
 $→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O $\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O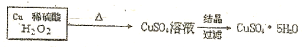 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | 动植物生长不可缺少的元素,是组成蛋白质的重要元素 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
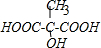 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | C | H2 | CO |
| △H/kJ•mol-1 | -393.5 | -285.8 | -283.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;F3C4的化学式为Fe3O4;F元素在周期表中的位置是第4周期第Ⅷ族.
;F3C4的化学式为Fe3O4;F元素在周期表中的位置是第4周期第Ⅷ族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中氢元素有三种同位素,它们的性质相同 | |
| B. | 三种同位素在化学反应中容易失去一个电子而呈+1价 | |
| C. | ${\;}_{1}^{1}$H原子失去一个电子后变成一个质子 | |
| D. | 氢在周期表中与碱金属同属ⅠA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用过量氨水除去Al3+溶液中的少量Fe3+ | |
| B. | 将混合气体通过灼热的铜网除去N2中的少量O2 | |
| C. | 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 | |
| D. | 用饱和NaHCO3溶液除去混在H2中的HCl气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com