
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入 ,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中, 显正电性。BrCl与水发生反应的化学方程式为 。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)=2 CuBr(s)+ Br2(g) △H=+105.4kJ/mol
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会 (填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为 。
科目:高中化学 来源: 题型:
草木灰中可能含K2CO3、K2SO4及NaCl等盐,将草木灰用蒸馏水浸取得浸取液进行实
验,下列根据现象得出的结论不正确的是
A.向浸取液中加入BaCl2有白色沉淀,说明其中含有SO42-
B.向浸取液中加入AgNO3溶液有白色沉淀,说明其中含有Cl-
C.洁净的铂丝蘸取浸取液少许,在酒精灯火焰上灼烧,火焰呈黄色,不能确定是否含K+
D.向浸取液中滴加稀硫酸,产生无色无味的气体,说明其中含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是
A.晶体硅熔点高硬度大,可用于制作半导体材料
B.氢氧化铝具有弱碱性,可用于制胃酸中和剂
C.漂白粉在空气中不稳定,可用于漂白纸张
D.氧化铁能与酸反应,可用于制作红色 涂料
涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法不正确的是 ( )
A.二氧化硫可广泛用于食品的漂白
B.葡萄糖可用于补钙药物的合成
C.聚乙烯塑料制品可用于食品的包装
D.次氯酸钠溶液可用于环境的消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________-。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之_________________________。
(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生H2,判断理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )。
A.NO2通入水中:3NO2+H2O === 2H++2NO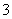 +NO
+NO
B.用两个铜电极电解CuSO4溶液:2Cu2++2H2O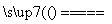 2Cu+O2↑+4H+
2Cu+O2↑+4H+
C.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=== SO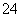 +Fe2++4H+
+Fe2++4H+
D.过量的CO2通入NaAlO2溶液中:2AlO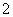 +CO2+3H2O=== 2Al(OH)3↓+CO
+CO2+3H2O=== 2Al(OH)3↓+CO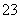
查看答案和解析>>
科目:高中化学 来源: 题型:
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为________,A与B在原子的电子层结构上的相同点是________。
(2)易与C发生化学反应的酸是________,
反应的化学方程式是_______________________________________________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:____________________________________________。
②要将纯碱高温熔化,下列坩埚中可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩锅 D.铁坩锅
(4)100 g 化合物C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A.1∶4 B.1∶5
C.2∶3 D.2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
在Cu+2H2SO4(浓)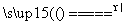 CuSO4+SO2↑+2H2O反应中:
CuSO4+SO2↑+2H2O反应中:
(1)________元素被氧化,________是氧化剂。
(2)用双线桥法标出该反应中电子转移的方向和数目。
Cu+2H2SO4(浓)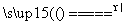 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)某一反应中有反应物和生成物的粒子共6种:SO 、I2、H+、SO
、I2、H+、SO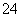 、I-、H2O,已知该反应中I2只发生如下过程:I2→I-,请回答:
、I-、H2O,已知该反应中I2只发生如下过程:I2→I-,请回答:
①该反应的还原剂是________(填分子或离子符号)。
②反应过程中,每有1molI2发生反应,转移的电子为____mol。
③写出该反应的离子方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com