
【题目】氰![]() 的化学性质与卤素
的化学性质与卤素![]() 很相似,化学上称之为拟卤素,其氧化性介于
很相似,化学上称之为拟卤素,其氧化性介于![]() 和
和![]() 之间,下列有关反应方程式不正确的是
之间,下列有关反应方程式不正确的是![]()
![]()
A.![]() 和NaOH溶液反应:
和NaOH溶液反应:![]()
B.![]() 和HCN反应:
和HCN反应: ![]() 浓)=
浓)=![]()
C.向KCN溶液中加入碘水:![]()
D.在NaBr和KCN混合溶液中通入少量![]() :
:![]()
科目:高中化学 来源: 题型:
【题目】830 K时,在密闭容器中发生下列可逆反应: CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0 。请回答下列问题:
CO2(g)+H2(g) ΔH<0 。请回答下列问题:
(1)若起始时c(CO) =2 mol·L-1,c(H2O) =3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____;用H2O表示的化学反应速率为_____。
(2)在相同温度下,若起始时c(CO) =1 mol·L-1,c(H2O) =2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,此时v(正)______ v(逆) (填“大于”“小于”或“等于”)。
(3)若降低温度,该反应的K值可能为______。
a.1 b.2 c.0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,氯气与单质碘需在温度稍低于70℃下反应制备ICl3。实验室可用如图装置制取ICl3。下列说法正确的是( )

A.装置A可选用的药品为二氧化锰与浓盐酸
B.装置B的作用是除杂,也作安全瓶,能监测实验进行时装置C中是否发生堵塞
C.装置C中的硅胶可用碱石灰代替
D.装置D最恰当的加热方式为酒精灯直接加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O
B.向NaAlO2溶液中加入NaHCO3溶液:HCO3-+AlO2-+H2O=CO2↑+Al(OH)3↓
C.铁电极电解饱和食盐水:Fe+2H2O![]() Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
D.向Ca(ClO)2溶液中通入过量的CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1、K2、K3之间的关系为K3=____________。
(2)T℃时,2NO(g)+Cl2(g)![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
(3)在2 L的恒容密闭容器中充入4 mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图I。
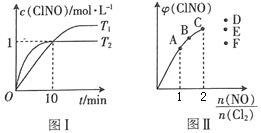
① 温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.υ(ClNO)=υ(NO) f.NO与ClNO的物质的量比值保持不变
② 反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
③ 温度为T2时,10 min时反应已经达到平衡,该反应的平衡常数K=____________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随![]() 的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当
的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当![]() 时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。
时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有机化学家发展了一些新型的有机试剂,如氟化试剂CpFluor-2,其与醇反应可以高产率、高选择性地生成氟代物。
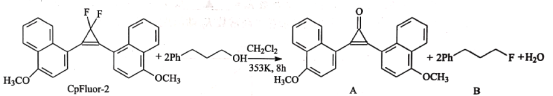
下列有关说法正确的是( )
A.该过程中只发生了取代反应B.CpFluor-2苯环上的一氯代物有3种
C.CH2Cl2能跟氢氧化钠醇溶液发生消去反应D.A中的官能团有醚键、羰基和碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
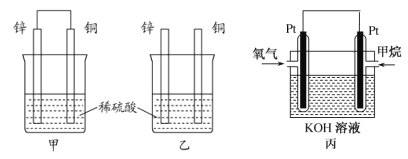
①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1824年法国巴拉尔发现溴。在他以前,有一家工厂曾将一瓶红棕色的液体送给德国化学家李比希检测,李比希凭经验武断地认为该液体为氯化碘![]() 化学式为ICl,性质和溴非常相似
化学式为ICl,性质和溴非常相似![]() 。后来看到巴拉尔发现溴的报道后,懊悔不已。下列关于ICl的有关说法中不正确的是
。后来看到巴拉尔发现溴的报道后,懊悔不已。下列关于ICl的有关说法中不正确的是
A.![]() 键为极性共价键
键为极性共价键
B.ICl分子为极性分子
C.![]() 间形成的是
间形成的是 ![]() 键
键
D.与NaOH溶液反应能生成![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业冶炼铜的原料,主要成分为 CuFeS2。试回答下列问题:
(1)基态硫原子核外电子有_____种不同运动状态,能量最高的电子所占据的原子轨道形状为_________。
(2)基态Cu原子的价层电子排布式为_________;Cu、Zn的第二电离能大小I2(Cu) _________I2(Zn)(填“>”“<”或“=”)。
(3)SO2分子中S原子的轨道杂化类型为_________,分子空间构型为_________;与SO2互为等电子体的分子有_________(写一种)。
(4)请从结构角度解释H2SO3的酸性比H2SO4酸性弱的原因_________。
(5)Cu(CH3CN)4比四氨合铜离子稳定,其配离子中心原子配位数为_________,配位体中σ键与π键个数之比为_________。
(6)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间距离为anm。则该晶体的密度为_________g/cm3(列出计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com