
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
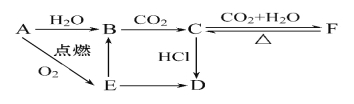
(1)写出B、C、D、F的化学式:
B. C. D. F. 。
(2)写出有关反应的离子方程式
B→C: ________________________________,
E→B: _______________________________,
F→C: _______________________________。
【答案】(1)NaOHNa2CO3NaClNaHCO3
(2)2OH-+CO2=CO32-+H2O
2Na2O2+2H2O=4Na++4OH-+O2↑
2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】
试题分析:E是淡黄色粉末,A燃烧生成E,所以A是Na,E是过氧化钠,钠和水反应生成氢氧化钠,则B是氢氧化钠,氢氧化钠吸收CO2生成C是碳酸钠,碳酸钠继续吸收CO2转化为碳酸氢钠,即F是碳酸氢钠,碳酸氢钠受热分解生成碳酸钠。碳酸钠与盐酸反应生成D,过氧化钠和盐酸反应也生成D,所以D是氯化钠。
(1)根据以上分析可知B、C、D、F的化学式分别是NaOH、Na2CO3、NaCl、NaHCO3;
(2)根据以上分析可知B→C的方程式为2OH-+CO2=CO32-+H2O;E→B的方程式为2Na2O2+2H2O=4Na++4OH-+O2↑;F→C的方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】关于核酸的叙述中,不正确的是( )
A. DNA和RNA都能携带遗传信息
B. DNA和RNA的基本单位都是核苷酸
C. DNA只分布在细胞核内,RNA只分布在细胞质中
D. 豌豆叶肉细胞内的核酸含有5种碱基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。则下列热化学方程式正确的是
A.C(s)+![]() O2(g)=CO(g);△H= - 393.5 kJ/mol
O2(g)=CO(g);△H= - 393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l);△H=+571.6 kJ/mol
C.CH4(g)+CO2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应2SO2(g)+O2(g) ![]() 2SO3(g)的化学反应速率,其中表示该反应进行的最快的是
2SO3(g)的化学反应速率,其中表示该反应进行的最快的是
A.v(SO2)=4 mol·L-1·min-1 B.v(O2)=3 mol·L-1·min-1
C.v(SO2)=0.1 mol·L-1·s-1 D.v(O2)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有__________性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1 mol Cl2参与反应时 释放145 kJ的热量,写出这个反应的热化学方程式:________________。
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检 测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:

请回答:
①操作Ⅰ中反应的离子方程式是___________________。
②确定操作Ⅱ完全反应的现象是___________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是___________________。
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol·L-1的Na2S2O3溶液10mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应FeO(s)+CO(g) ![]() Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 蚂蚁分泌的蚁酸主要成分是甲酸(结构式为![]() ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体。甲酸在浓硫酸作用下容易分解产生CO。某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体。甲酸在浓硫酸作用下容易分解产生CO。某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
I、该组同学选择如图1所示的装置探究HCOOH在浓硫酸作用下分解产生了CO,请完成下列各小题。
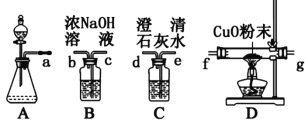

图1 图2
⑴写出甲酸分解的化学方程式 ;
⑵装置的连接顺序a ;
⑶HCOOH的分解产物中有CO的现象 ;
⑷该实验设计有一处明显的缺陷是 ;
II、该组同学分析了甲酸分子结构后,认为甲酸能发生银镜反应,并设计了如图2所示的实验。
⑸依图所示的实验,加热20分钟后并没有出现光亮的银镜。请解释实验中没有产生银镜的原因 ;
⑹请设计实验来验证你的解释 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com