
| A. | 向铁粉中加入一定量的稀硝酸 | |
| B. | 向MgSO4,H2SO4的混合液中滴入过量Ba(OH)2溶液 | |
| C. | 向NaOH溶液中通入一定量CO2气体 | |
| D. | 将物质的量浓度之比为2:7的AlCl3和NaOH溶液等体积混合 |
分析 A.向稀硝酸中加入铁粉可生成Fe(NO3)2、Fe(NO3)3等;
B.向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液,反应生成Mg(OH)2和BaSO4沉淀;
C.二氧化碳和氢氧化钠溶液能生成碳酸氢钠或碳酸钠;
D.AlCl3和NaOH反应生成氯化铝和偏铝酸钠.
解答 解:A.向稀硝酸中加入铁粉,如Fe过量,溶液中可能存在Fe(NO3)2、Fe(NO3)3等溶质,如Fe不足,则存在HNO3、Fe(NO3)3,故A错误;
B.向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液,反应生成Mg(OH)2和BaSO4沉淀,最后溶液中只有过量的Ba(OH)2,只有一种溶质,故B正确;
C.向NaOH溶液中通入CO2气体,当CO2过量时,可能生成Na2CO3或NaHCO3等物质,故C错误;
D.将物质的量浓度之比为2:7的AlCl3和NaOH溶液等体积混合,生成的氢氧化铝沉淀部分溶解,所以溶液中的溶质为氯化铝和偏铝酸钠,故D错误.
故选B.
点评 本题考查元素化合物知识,题目难度不大,本题注意相关物质的性质,学习中注重相关基础知识的积累.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲苯、苯乙烯都既使酸性高锰酸钾褪色,也能使溴水褪色 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 肥皂是高级脂肪酸与甘油的酯化产物 | |
| D. | 石蜡是从石油中获取的油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
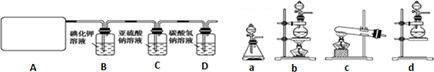
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4+H2S═CuS↓+H2SO4 | |
| B. | 2FeCl3+Cu═2FeCl2+CuCl2 | |
| C. | .Cu2 (OH)2CO3 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O | |
| D. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
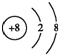 ;A、F两元素组成的化合物电子式为Na+[:H]-.
;A、F两元素组成的化合物电子式为Na+[:H]-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,它可以跟强碱反应,但是不能与任何酸反应 | |
| B. | 根据SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑的反应,可推知硅酸酸性比碳酸强 | |
| C. | 二氧化碳气体通入硅酸钠溶液中可以制得硅酸 | |
| D. | 二氧化硅对应的水化物只有H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
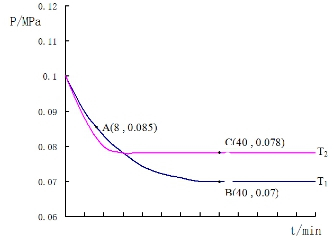 SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SrCO3的溶解度不变,KSP不变 | B. | SrCO3的溶解度不变,KSP增大 | ||
| C. | SrCO3的溶解度增大,KSP不变 | D. | SrCO3的溶解度减小,KSP增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
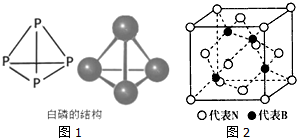 利用周期表中同族元素的相似性,可预测元素的性质.
利用周期表中同族元素的相似性,可预测元素的性质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com