
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①二氧化碳过量,反应生成碳酸氢根离子;
②酸性条件下,反应产物中不能存在氢氧根离子;
③碳酸为二元弱酸,电离方程式分步进行,主要写出第一步电离即可;
④次氯酸根离子的水解为可逆反应,应该用可逆号;
⑤酸性条件下,用H2O2将I-氧化为I2;
⑥反应后溶液呈中性,氢离子与氢氧根离子恰好反应.
解答 解:①向NaAlO2溶液中通入过量的CO2,反应生成氢氧化铝沉淀和碳酸氢根离子,正确的离子方程式为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,故①错误;
②向酸性KMnO4溶液中滴加适量H2C2O4溶液,原溶液紫色褪去,正确的离子方程式为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O,故②错误;
③碳酸的电离分步进行,主要以第一步为主,正确的电离方程式为:H2CO3?H++HCO3-,故③错误;
④NaClO溶液中ClO-的水解为可能反应,应该用可逆号,正确的离子方程式为:ClO-+H2O?HClO+OH-,故④错误;
⑤酸性条件下,用H2O2将I-氧化为I2,反应的离子方程式为:H2O2+2I-+2H+═I2+2H2O,故⑤正确;
⑥向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性,氢离子、氢氧根离子都完全反应,正确的离子方程式为:22H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故⑥错误;
故选A.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
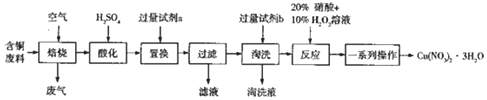
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
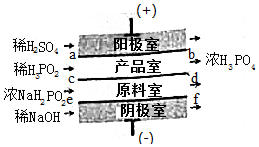 次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )
次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )| A. | 阳极室反应为:2H2O-4e-=O2↑+4H+ | |
| B. | ab,ef均为阳膜,cd为阴膜 | |
| C. | 若将稀H2SO4改为H3PO3,撤去ab膜,产品中总混有杂质的原因是:H3PO2在阳极放电而被氧化生成H3PO4 | |
| D. | 通电后产品室中的H+离子向原料室迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
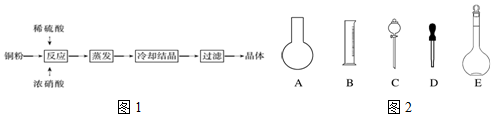
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙显红色的溶液中:Fe2+、ClO-、Na+、SO42- | |
| B. | 溶有少量NaOH的溶液中:NH4+、Mg2+、HCO3-、NO3- | |
| C. | 水电离出的c(H+)=1.0×10-12mol•L-1溶液中:K+、Na+、S2-、SO32- | |
| D. | 溶有大量FeCl3的溶液中:NH4+、Na+、CI-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
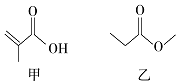
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成反应 | |
| C. | 与甲具有相同官能团的同分异构体还有2种 | |
| D. | 与乙具有相同官能团的同分异构体还有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
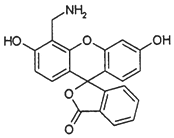
| A. | 分子中三个苯环处于同一平面 | |
| B. | 1 mol 4-AFMF 最多可与2molNaOH 反应 | |
| C. | 在酸性条件下水解,水解产物只有1种 | |
| D. | 能与溴水、FeCl3溶液及稀硫酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
| 平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
| 反应物转化率 | a1 | a2 | a3 | |
| 体系压强(Pa) | p1 | P2 | P3 | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com