
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH+4、I-、NO3-
C.FeCl2溶液:K+、Na+、SO42-、AlO2-
D.  =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列解释事实的离子方程式正确的是
A.铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3- =Fe3+ + NO↑+ 2H2O
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液: Fe +2H
+2H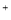 +H2O2=Fe
+H2O2=Fe +2H2O
+2H2O
C.向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O
D.0.01 mol·L—1 NH4Al(SO4)2溶液与0.02 mol·L—1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH—=2BaSO4↓+Al(OH)3↓+NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
有关下列图示的叙述正确的是()
A.图1总反应为:2Cu+H2O Cu2O+H2↑则铜电极发生还原反应:2Cu+2OH--2e-=Cu2O+H2O
Cu2O+H2↑则铜电极发生还原反应:2Cu+2OH--2e-=Cu2O+H2O
B.图2中a、b试管内分别盛有食盐水和氯化铵溶液,放置一段时间后,红墨水柱两边的液面变成左低右高
C.图3中铜电极上不能产生气泡
D.图4中C、D、E、F都是惰性电极,向乙中滴入酚酞试液,F极附近显红色,则欲用丙装置给铜镀银,铜件应该为G极
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列有关化学用语的表示正确的是()
A.N2的电子式: 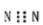 B. 甲烷分子的比例模型是
B. 甲烷分子的比例模型是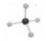
C. 硝基和二氧化氮两种粒子所含电子数相等 D. 甲基的电子式: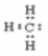
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:填空题
(14分)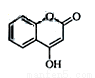 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
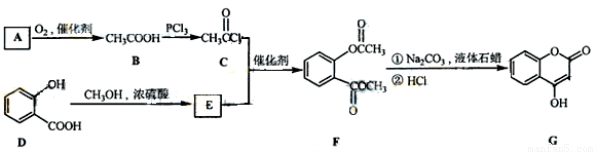
(1)A与银氨溶液反应有银镜生成,则A的结构简式是 。
(2)B→C的反应类型是 。
(3)E的结构简式是 。
(4)写出F和过量NaOH溶液共热时反应的化学方程式 。
(5)下列关于G的说法正确的是 。
a.能与溴单质反应 b. 能与金属钠反应
c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:填空题
(15分)硅基太阳电池需用化合物甲作钝化材料,甲的摩尔质量为140 g·mol-1,其中硅元素的质量分数为60%。已知1 molNH3与足量的化合物乙充分反应后可得到35 g 甲与6 g H2。工业上制乙的流程如下: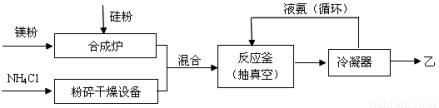 请回答下列问题:
请回答下列问题:
(1)乙的电子式是 ;比较热稳定性:乙_______NH3(填>,<或=)。
(2)NH3与足量的化合物乙反应制甲的化学方程式是 。
(3)合成炉内物质需在保护气氛下高温合成,下列气体可作保护气的有 (填字母编号)。
A.O2 B.H2 C.N2 D.CO2 E.Ar
(4)上述生产乙的过程中液氨的作用是______________________________________。
(5)甲与少量H2SO4溶液反应只得到H2SiO3和盐M两种产物,写出该反应的离子方程式 。请设计验证产物盐M的实验方案 。
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:选择题
下列各反应对应的离子方程式正确的是( )
A.次氯酸钠溶液中通入过量二氧化硫ClO- + H2O + SO2 = HClO + HSO3-
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+ Ca2++2OH-= CaCO3↓+2H2O+CO32-
C.氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+ H++SO42— = BaSO4↓+H2O
D.50 mL 1mol/L的NaOH溶液中通入0.03 mol H2S 5OH- + 3H2S = HS— + 2S2- + 5H2O
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:填空题
(16分)草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
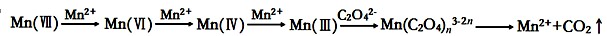
【提出假设】假设1: 该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3: K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是
【设计、完成实验】
(1)称取 g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
① 在上述过程中必须用到的2种定量仪器是托盘天平和 。
② 下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪 色时间 (s) | |||
0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 |
| 18 |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
则x = ,假设 成立
(3)由于KMnO4能氧化水中有机物等因素,配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,
则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。
上述实验中KMnO4溶液的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:实验题
(12分)某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
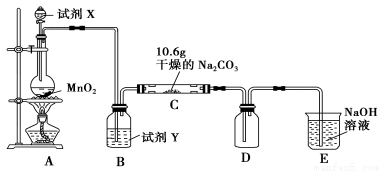
(1)写出装置A中发生反应的化学方程式: 。
(2)写出试剂Y的名称: 。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄棕色的气体,其为含氯氧化物。可以确定的是C中含氯化合物(盐)只有一种,且含有NaHCO3,现对C的成分进行猜想和探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 、 。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于a、b试管中。 |
|
步骤2: | 情况①: 情况②: |
步骤3: |
|
(4)D中黄棕色的气体化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com