
【题目】PdCl2广泛用作催化剂和一些物质的检测试剂。由Pd(NH3)2Cl2制备PdCl2工艺流程如图所示。

(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+。肼与少量稀硫酸混合后,得到产物的化学式为___。
(2)对工艺流程图中的滤液处理办法最好的是:___
a.返到提钯废液中,循环使用 b.转化为无毒物质后排放 c.深埋于地下
(3)王水溶钯时,Pd被氧化为H2PdCl4。同时得到唯一还原产物亚硝酰氯(NOCl)。反应消耗的HCl与HNO3的物质的量之比为___。
(4)赶硝,是将残余的NO3浓度降低到不大于0.04%。实验数据记录如表:
表一:不同HCl用量和MxOy用量(每10gPd)与NO3残留量
HCl用量(mL) | MxOy用量(mL) | NO3含量(%) |
5 | 0、10、20、30、40 | 0.15、0.10、0.05、0.04、0.03 |
10 | 0、5、10、15、20 | 0.10、0.08、0.05、0.03、0.02 |
15 | 0、5、10、15、20 | 0.08、0.06、0.05、0.03、0.02 |
处理1吨Pd,需要用到HCl和MxOy的总体积至少为___m3(合理选择表格里相关数据计算)。
(5)煅烧过程发生分解反应,化学方程式为:___。
(6)浸有磷钼酸铵溶液的氯化钯试纸遇微量CO立即变成蓝色。原理较为复杂,第一步是CO还原PdCl2得到Pd单质,同时有常见的氧化物生成。写出反应原理中第一步的化学方程式:___
【答案】(N2H5)2SO4 a 5:1 2.5 H2PdCl4![]() PdCl2+2HCl↑ H2O+CO+PdCl2=Pd+CO2+2HCl
PdCl2+2HCl↑ H2O+CO+PdCl2=Pd+CO2+2HCl
【解析】
(1)根据肼是二元弱碱分析,与少量硫酸混合,即只能结合一个质子书写产物。
(2)从提高原料利用率分析,处理最好的方法是循环使用。
(3)根据反应中的元素化合价变化分析氧化还原反应配平和氧化剂和还原剂的比例。
(4)从实验结果可知,加入氯化氢的同时加入MxOy,可大大降低生成的PdCl2中的NO3的含量,且MxOy用量越多,NO3的含量越少,MxOy用量相同时,HCl的用量越大,PdCl2中的NO3的含量越低。当每10gPd的HCl的用量为10mL,MxOy用量为15mL时, NO3的含量可降低至0.03%,达到处理标准,当处理量为1吨Pd时,需要用到HCl和MxOy的总体积至少为(10mL+15mL)。据此计算。
(5)根据流程煅烧过程中分解氯化氢和PdCl2分析。
(6)一氧化碳还原PdCl2得到Pd单质,同时有常见的氧化物二氧化碳生成,结合元素可得有水参与,据此书写。
(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+.,肼与少量稀硫酸混合,只能生成N2H5+,反应为:2N2H4+H2SO4=(N2H5)2SO4;故答案为:(N2H5)2SO4;
(2)对工艺流程图中的滤液处理办法最好的是返到提钯废液中,循环使用,提高原料利用率;故答案为:a;
(3)王水溶钯时,Pd被氧化为H2PdCl4.同时得到唯一还原产物亚硝酰氯(NOCl),反应为:5HCl+HNO3+Pd=H2PdCl4+NOCl+2H2O,故反应消耗的HCl与HNO3的物质的量之比为5:1;故答案为:5:1;
(4)从实验结果可知,加入HCl的同时加入MxOy,可大大降低生成的PdCl2中的NO3的含量,且MxOy用量越多,NO3的含量越少,MxOy用量相同时,HCl的用量越大,PdCl2中的NO3的含量越低。当每10gPd的HCl的用量为10mL,MxOy用量为15mL时, NO3的含量可降低至0.03%,达到处理标准,当处理量为1吨Pd时,需要用到HCl和MxOy的总体积至少为1×106g(10mL+15mL)=2.5×106cm3=2.5m3;故答案为:2.5;
(5)在煅烧过程,会生成氯化氢气体和PdCl2,反应的化学方程式为H2PdCl4![]() PdCl2+2HCl↑;故答案为:H2PdCl4
PdCl2+2HCl↑;故答案为:H2PdCl4![]() PdCl2+2HCl↑;
PdCl2+2HCl↑;
(6)CO还原PdCl2得到Pd单质,生成的常见氧化物为CO2,根据元素守恒可知,H2O参与反应,提供氧原子,反应的化学方程式为:H2O+CO+PdCl2=Pd+CO2+2HCl;故答案为:H2O+CO+PdCl2=Pd+CO2+2HCl。


科目:高中化学 来源: 题型:
【题目】按要求完成下列问题。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,其中还原剂是___。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是_____________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____________(填“大于”或“小于”)生成物化学键形成放出的总能量。
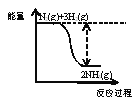
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____________(填序号)。
a.容器中N2、H2、NH3共存 b.N2、H2、NH3的物质的量之比为1:3:2
c.容器中的压强不随时间变化 d.N2、NH3浓度相等
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为_________。
(4)下列各反应中,符合如图所示能量变化的是_____________(填序号)。
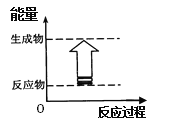
a.H2和Cl2的反应 b.Al和盐酸的反应 c.Na和H2O的反应 d.Ba(OH)2·8H2O和NH4C1的反应
(5)海水资源前景广阔。
①列举一种海水淡化的方法______________。
②采用空气吹出法从海水中提取溴的过程中,吸收剂SO2和溴蒸气反应生成氢溴酸以达到富集的目的,该反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,①5 g H2 ②11.2 L O2 ③2 mol H2O ④6.02×1023个 CO2分子。
(1)5gH2 的物质的量是_______,体积是_______;
(2)6.02×1023个CO2分子的物质的量是_____,质量是______;
(3)所含分子数最多的是______(请用序号回答,后同);
(4)所含原子数最多的是______;
(5)质量最大的是_______;
(6)体积最大的是_______;
(7) 体积最小的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H< 0,反应到达平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g) △H< 0,反应到达平衡后,为提高CO的转化率,下列措施中正确的是( )
A. 增加压强B. 降低温度或增大H2O(g)的浓度
C. 增大CO的浓度D. 更换催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。请回答下列问题:
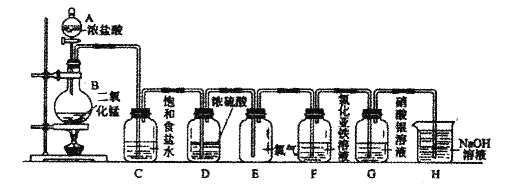
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的化学方程式为:
_________________________________________________________
(2)C中盛有饱和食盐水,其作用是________________________________,D中浓硫酸的作用是___________________________________。
(3)F中是FeCl2溶液,F中发生反应的离子方程式为___________________
(4)G中是AgNO溶液,现象是______________________________
(5)H中盛有Na0H溶液,其作用是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,将前者和后者混合时,无论前者是否过量,都能用同一个化学方程式表示的是( )
A.![]() 溶液,NaOH溶液B.稀
溶液,NaOH溶液B.稀![]() ,
,![]() 溶液
溶液
C.澄清石灰水,![]() D.氨水,
D.氨水,![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4 NH4++6HCHO===3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数______ (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_______色,且_____________。
(2)滴定结果如下表所示:

若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为______
(3)实验室现有3种酸碱指示剂,其pH变色范围如下:
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.1000mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是__________。
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
(4)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为_________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10—11,Ksp[Cu(OH)2]=2.2×10—20。
(5)在25 ℃下,将a mol·L—1的氨水与0.01 mol·L—1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl—),则溶液显_______性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上常将酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:__H++__MnO4-+__H2C2O4→__CO2↑+__Mn2++__________
(1)配平以上离子方程式,并在![]() 中填上所需的微粒或数字。
中填上所需的微粒或数字。
(2)该反应中的还原剂是___。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为___mol。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是__。
②溶解沉淀时__(能或不能)用稀盐酸,原因是___。
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】艾司洛尔是预防和治疗手术期心动过速或高血压的一种药物,艾司洛尔的一种合成路线如下:
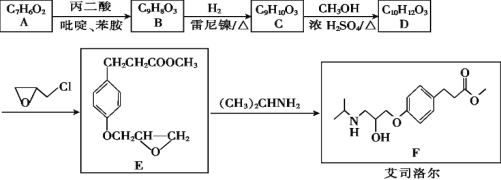
回答下列问题:
(1)丙二酸的结构简式为_______;E中含氧官能团的名称是_______。
(2)D生成E的反应类型为____________。
(3)C的结构简式为________________。
(4)A遇FeCl3溶液发生显色反应,1 mol A和1 mol丙二酸在吡啶、苯胺中反应生成1 mol B、1 mol H2O和1 mol CO2,B能与溴水发生加成反应,推测A生成B的化学方程式为____。
(5)X是B的同分异构体,X同时满足下列条件的结构共有____种,其中核磁共振氢谱有五组峰的结构简式为____。
①可与碳酸氢钠溶液反应生成二氧化碳
②遇FeCl3溶液发生显色反应
③除苯环外不含其他环
(6)写出以苯甲醇和丙二酸为原料制备![]() 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com