
| A. | 2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023个 | |
| B. | 含1 mol FeCl3的FeCl3饱和溶液完全反应可以生成1mol Fe(OH)3胶体粒子 | |
| C. | 11.2L二氧化碳气体中所含的分子数为0.5NA | |
| D. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1mol |
分析 A、2.3g钠的物质的量为0.1mol,根据电子守恒,0.1mol钠完全反应转移了0.1mol电子;
B、胶体粒子是大量氢氧化铁的聚合体;
C、根据n=$\frac{V}{Vm}$其中气体摩尔体积Vm在标准状况下为22.4L/mol,气体所处的状态不知道,因此无法求出11.2L二氧化碳气体物质的量;
D、根据1mol粒子数的规定判断.
解答 解:A、钠为1价金属,2.3g钠的物质的量为0.1mol,无论生成氧化钠还是过氧化钠,0.1mol钠完全反应失去0.1mol电子,失电子数是0.1×6.02×1023,故A正确;
B、Fe(OH)3胶体粒子胶体粒子是大量氢氧化铁的聚合体,含1mol FeCl3溶质的溶液形成胶体后,胶体粒子远远小于1mol,故B错误;
C、根据n=$\frac{V}{Vm}$其中气体摩尔体积Vm在标准状况下为22.4L/mol,气体所处的状态不知道,因此无法求出11.2L二氧化碳气体物质的量,所含的分子数目也无法求出.故C错误;
D、碳原子指含有6个质子6个中子的原子,本选项未明确,故D错误;
故选A.
点评 本题考查物质的量有关计算、分散系等,注意基础知识的积累与理解,题目难度不大,有利于基础知识的巩固.


科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,0.1NA个HCl分子的体积为22.4L | |
| B. | 标准状况下,22.4L氖气含有2NA个原子 | |
| C. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-离子数目为0.6NA | |
| D. | 1mol氖气中含有的电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 将直径等于2.5微米的颗粒物分散于水即成为胶体 | |
| C. | 雾具有丁达尔现象 | |
| D. | 增加使用汽车,提高交通效率可缓解雾霾天气的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| C. | 碳酸钡与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氯气和石灰乳反应:Ca(OH)2+Cl2═Ca2++Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将20 g NaOH 溶解在500mL 水中 | |
| B. | 将22.4 L HCl 气体溶于水配成1 L 溶液 | |
| C. | 将1 L 10 mol•L-1浓盐酸加入9 L 水中 | |
| D. | 将10 g NaOH 溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
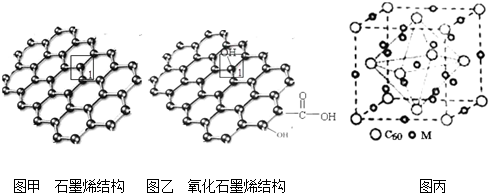
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
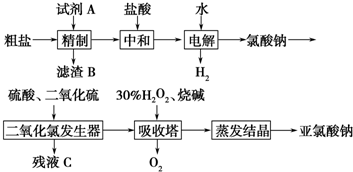
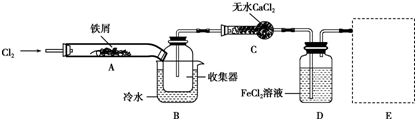
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com