
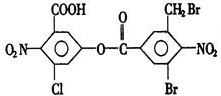
| A. | 5mol | B. | 6mol | C. | 7mol | D. | 8mol |
分析 由结构可知,-COOH、-Cl、-Br、-COOC-均与NaOH反应,且-COOC-水解生成的酚-OH、-X水解的酚-OH也与NaOH反应,以此来解答.
解答 解:由结构可知,-COOH、-Cl、-Br、-COOC-均与NaOH反应,且-COOC-水解生成的酚-OH、-X水解的酚-OH也与NaOH反应,除-COOH、-CH2Br与NaOH以1:1反应,苯环上-Cl、-Br及-COOC-均与NaOH1:2反应,则1mol有机化合物与足量的NaOH溶液混合,共消耗NaOH的物质的量为8mol,
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意水解生成的酚与NaOH反应,题目难度不大.


科目:高中化学 来源: 题型:推断题
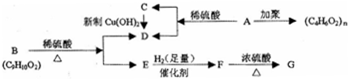
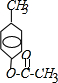 ;
;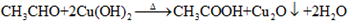 ,反应类型氧化反应;F→G
,反应类型氧化反应;F→G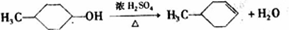 ,反应类型消去反应.
,反应类型消去反应.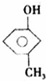 、
、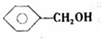 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是直线形结构 | |
| B. | 中心原子都采取sp1杂化 | |
| C. | NH3为三角锥形结构,CO2为直线形结构 | |
| D. | 氮原子和碳原子上都没有孤对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是置换反应 | B. | FeCl3是氧化剂 | ||
| C. | Cu是还原剂,被腐蚀 | D. | 该反应属于离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠可用作潜艇里氧气的来源 | B. | 二氧化硅是制造光电池的原料 | ||
| C. | 氯气可用于制造漂白粉 | D. | 硅酸钠溶液可用作木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4 NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) | |
| C. | 明矾既可以用于净水,又可杀菌消毒 | |
| D. | 恒温恒容下,某可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com