
| A. | 用丁达尔效应可以鉴别溶液和胶体 | |
| B. | 用分液漏斗分离碘与CCl4的混合液 | |
| C. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| D. | 某溶液中滴加NaOH溶液有蓝色沉淀,说明原溶液中有Cu2+ |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 腐蚀中正极反应为:2H++2e-=H2↑ | |
| B. | 腐蚀中负极反应为:Fe-3e-=Fe3+ | |
| C. | 钢铁设备上连接铜块可以防止腐蚀 | |
| D. | 钢铁与外加直流电源的正极相连可以防止腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L的氧气中含氧原子数为2NA | |
| B. | 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 乙烯和环丙烷组成的28g混合气体中氢原子的个数为4NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,钠露置在空气中易被氧气氧化为过氧化钠,因此应保存在煤油里 | |
| B. | 钠是强还原剂,它能从盐溶液中置换出金属活动顺序表中排在钠后面的金属 | |
| C. | 钠蒸气充入灯泡中制成钠灯,常用于公路照明 | |
| D. | 金属钠着火时,能用水来灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br- | B. | OH- | C. | HCO3- | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
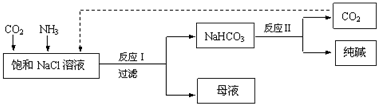
| A. | 反应Ⅰ原理为CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl | |
| B. | 向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 | |
| C. | 反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 | |
| D. | 往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com