
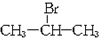
 ;
;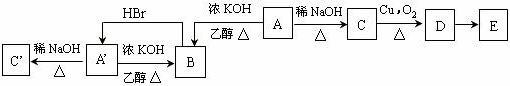
分析 气态物质B是烃,含碳85.7%,则B中C、H原子个数之比=$\frac{85.7%}{12}:$$\frac{14.3%}{1}$=1:2,B为气态,B和溴化氢发生加成反应生成A′,A′为溴代烷,化合物A和A′互为同分异构体,E为一元羧酸,其分子式为CnH2nO2,E为酸性物质,其中碳氢含量共为63.6%,氧元素含量=$\frac{16×2}{14n+16×2}×100%$=1-63.6%=36.4%,n=4,所以B为丁烯,C′不发生类似图中C的系列转化,则C′中羟基位于里边,C中羟基位于边上,则C′结构简式为CH3C(OH)(CH3)2、A′为CH3CBr(CH3)2、B为CH2=C(CH3)2、A为(CH3)2CHCH2Br、C为(CH3)2CHCH2OH、D为(CH3)2CHCHO、E为(CH3)2CHCOOH,据此分析解答.
解答 解:气态物质B是烃,含碳85.7%,则B中C、H原子个数之比=$\frac{85.7%}{12}:$$\frac{14.3%}{1}$=1:2,B为气态,B和溴化氢发生加成反应生成A′,A′为溴代烷,化合物A和A′互为同分异构体,E为一元羧酸,其分子式为CnH2nO2,E为酸性物质,其中碳氢含量共为63.6%,氧元素含量=$\frac{16×2}{14n+16×2}×100%$=1-63.6%=36.4%,n=4,所以B为丁烯,C′不发生类似图中C的系列转化,则C′中羟基位于里边,C中羟基位于边上,则C′结构简式为CH3C(OH)(CH3)2、A′为CH3CBr(CH3)2、B为CH2=C(CH3)2、A为(CH3)2CHCH2Br、C为(CH3)2CHCH2OH、D为(CH3)2CHCHO、E为(CH3)2CHCOOH,
(1)通过以上分析知,A、B结构简式分别为(CH3)2CHCH2Br、CH2=C(CH3)2,故答案为:(CH3)2CHCH2Br;CH2=C(CH3)2;
(2)①B和HBr发生加成反应生成A′,反应方程式为CH2=C(CH3)2+HBr$\stackrel{一定条件下}{→}$CH3CBr(CH3)2;
②C为(CH3)2CHCH2OH、D为(CH3)2CHCHO,在Cu作催化剂、加热条件下,C发生氧化反应生成D,反应方程式为2(CH3)2CHCH2OH+O2$→_{△}^{Cu}$2(CH3)2CHCHO+2H2O,
③D为(CH3)2CHCHO、E为(CH3)2CHCOOH,D发生氧化反应生成E,反应方程式为2(CH3)2CHCHO+O2$\stackrel{一定条件下}{→}$2(CH3)2CHCOOH,
故答案为:CH2=C(CH3)2+HBr$\stackrel{一定条件下}{→}$CH3CBr(CH3)2;2(CH3)2CHCH2OH+O2$→_{△}^{Cu}$2(CH3)2CHCHO+2H2O;2(CH3)2CHCHO+O2$\stackrel{一定条件下}{→}$2(CH3)2CHCOOH;
(3)A为(CH3)2CHCH2Br,先将A和NaOH的水溶液混合加热,然后向混合溶液中加入稀硝酸来中和NaOH,然后向溶液中加入硝酸银溶液,如果溶液中有淡黄色沉淀就说明A中含有溴元素,
故答案为:取少量A溶液和NaOH的水溶液混合加热,然后向混合溶液中加入少量稀硝酸中和NaOH,然后向溶液中滴加硝酸银溶液,如果溶液中有淡黄色沉淀就说明A中含有溴元素.
点评 本题考查有机物推断,为高考高频点,根据B中含碳量、E中含O量结合B状态结合反应条件进行推断,熟悉常见物质官能团及其性质是解本题关键,知道卤代烃中卤原子检验方法,题目难度不大.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述气态化合物分子中所有原子最外层电子数均为8 | |
| B. | X、N、Z都可与W形成既有极性共价键又有非极性共价键的化合物 | |
| C. | 化合物W4XY2Z可能是离子化合物,也可能是共价化合物 | |
| D. | 沸点:W2Z>YW3>XW4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| C | 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉) | 阴极逸出气体且附近溶液渐呈红色 |
| D | 以Pb为负极,硫酸溶液为电解质的铅蓄电池,在放电过程中 | 负极质量增加,SO42-向负极迁移,溶液pH增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
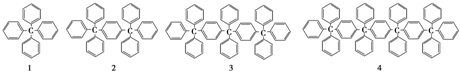
| A. | C198H146 | B. | C196H155 | C. | C196H146 | D. | C198H155 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
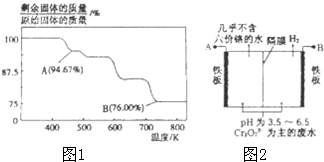 CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
铝制饭盒 | 聚乙烯盒 | 铁罐车 | 带玻璃塞的试剂瓶 |
| 不宜长时间存放 酸性或碱性的食物 | 能用于盛放食品 | 可用于运输浓硫酸 | 可用于盛放 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
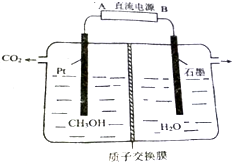 工业废水中的甲醇也可用电化学方法处理,原理如图所示.
工业废水中的甲醇也可用电化学方法处理,原理如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com