
����Ŀ����ѡ������ʵ�鷽���������ʣ������뷽����������ں����ϡ�
A����ȡ��Һ�� B�����ȷֽ� C���ᾧ�� D����Һ�� E�������� F������ G�����˷�
(1)___________����ˮ��ú�͵Ļ���
(2)___________����ˮ�;ƾ���
(3)___________������ˮ�е����ˮ��
������98%��Ũ����(g��1.84g/cm3)����Ũ��Ϊ0.5mol/L��ϡ����480ml���ɹ�ѡ��������У��ٲ����� ����ƿ ���ձ� �ܽ�ͷ�ι� ����Ͳ ��������ƽ��ҩ�ס�
��ش��������⣺
(4)���������У�������ϡH2SO4ʱ����Ҫʹ�õ���___________(�����)����ȱ�ٵ�������______________________��
(5)�����㣬��ŨH2SO4�����Ϊ___________�����ʵ������15mL��20mL��50mL����ͲӦѡ��_______mL����Ͳ��ã���ȡʱ������Ͳ������ʹŨ��__________(��ƫ�ߡ�����ƫ�͡�������Ӱ�족)��
(6)��Ũ�������ձ��ڱ�����ע��ʢˮ���ձ��У����ò��������Ͻ����Ŀ����____________����δ��ȴ�����±㽫��Һת��������ƿ��ʹŨ��ƫ________��
���𰸡�D F A �ڢޢ� 500ml����ƿ 13.6ml 15 ƫ�� Ѹ��ɢ�ȷ�ֹ���� ��
��������
I.(1)ˮ��ú���ǻ������ݵ�����Һ�����ʣ����÷�Һ�������룬�ʺ���ѡ����D��
(2)�ƾ���ˮ�ǻ��ܣ����е㲻ͬ��Һ�����ѡ�������룬�ʺ���ѡ����F��
(3)�岻������ˮ���������л��ܼ�����ѡ����ȡ��Һ�����룬�ʺ���ѡ����A��
II.(4) ���Ʋ�������ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ������Ͳ��ȡŨ������Һ���ձ���ϡ�ͣ���ȴ��ת�Ƶ�500mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ�������в���������Ͳ����ͷ�ιܡ�С�ձ���500ml����ƿ�������ò�������������ƿ��������ƽ��ҩ�ף��ʺ���ѡ���Ǣڢޢߣ�û�й����480mL������ƿ������ѡ�������� �����������ԭ��Ӧ��ѡ��500mL����ƿ������ȱ��500mL����ƿ��
(5) 98%��Ũ��������ʵ���Ũ��c=![]() ����Һ��ϡ��ǰ�����ʵ����ʵ������䣬����18.4mol/L��V=0.5mol/L��500mL�����V=13.6mL��ѡ���������������ȡҺ������Խ�ӽ������ԽС���������Ҫ��ȡ13.6mLŨ���ᣬӦ��ѡ��15mL����Ͳ����ȡʱ������Ͳ��������ȡ��Һ��ƫ�٣���c=
����Һ��ϡ��ǰ�����ʵ����ʵ������䣬����18.4mol/L��V=0.5mol/L��500mL�����V=13.6mL��ѡ���������������ȡҺ������Խ�ӽ������ԽС���������Ҫ��ȡ13.6mLŨ���ᣬӦ��ѡ��15mL����Ͳ����ȡʱ������Ͳ��������ȡ��Һ��ƫ�٣���c=![]() ��֪��ʹŨ��ƫ�ͣ�
��֪��ʹŨ��ƫ�ͣ�
(6)Ũ��������ˮ��ų��������ȣ�ʹ��Һ���¶����ߣ���Ũ�������ձ��ڱ�����ע��ʢˮ���ձ��У����ò��������Ͻ����Ŀ����Ѹ��ɢ�ȷ�ֹ���У���δ��ȴ�����±㽫��Һת��������ƿ�����ݺ����Һ�ָ������£�Һ�岻���̶��ߣ����ʹŨ��ƫ�ߡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NOx����ҪָNO��NO2���Ǵ�����Ҫ��Ⱦ��֮һ����Чȥ�������е�NOx�ǻ�����������Ҫ���⡣
��1����ˮ����NOx������Ȼ�ѧ����ʽ���£�
2NO2��g��+H2O��l��![]() HNO3��aq��+HNO2��aq�� ��H=116.1 kJ��mol1
HNO3��aq��+HNO2��aq�� ��H=116.1 kJ��mol1
3HNO2��aq��![]() HNO3��aq��+2NO��g��+H2O��l�� ��H=75.9 kJ��mol1
HNO3��aq��+2NO��g��+H2O��l�� ��H=75.9 kJ��mol1
��Ӧ3NO2��g��+H2O��l��![]() 2HNO3��aq��+NO��g������H=___________kJ��mol1��
2HNO3��aq��+NO��g������H=___________kJ��mol1��
��2����ϡ��������NOx���õ�HNO3��HNO2�Ļ����Һ�����û����Һ�ɻ�ý�Ũ�����ᡣд�����ʱ�����ĵ缫��Ӧʽ��____________________________________��
��3��������(NH2)2COˮ��Һ����NOx�����չ����д���HNO2��(NH2)2CO����N2��CO2�ķ�Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��____________________________________��
��4�������������£����ʹ���M�ܴ�NH3��NOx��Ӧ����N2��
��NH3��NO2����N2�ķ�Ӧ�У�������1 mol N2ʱ��ת�Ƶĵ�����Ϊ__________mol��
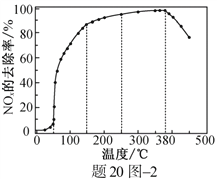
�ڽ�һ��������O2��NH3��NOx�Ļ�����壬����ͨ��װ�д���M�ķ�Ӧ���з�Ӧ��װ�ü���20ͼ1����

��Ӧ��ͬʱ��NOx��ȥ�����淴Ӧ�¶ȵı仯��������20ͼ2��ʾ����50��250 �淶Χ�������¶ȵ����ߣ�NOx��ȥ������Ѹ��������������������Ҫԭ����____________________________������Ӧ�¶ȸ���380 ��ʱ��NOx��ȥ����Ѹ���½���ԭ�������___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ѧ��һ����ʵ��Ϊ������ѧ�ƣ���ѧʵ���ǻ�ѧѧϰ����Ҫ���ݡ��������յ�֪ʶ�жϣ������й�ʵ�������������ȷ����________(�����и������)��
A�����Լ�ƿ��ȡ�����κ�ҩƷ������ʣ��������ٷŻ�ԭ�Լ�ƿ��
B����ϡ����ϴ��ʢ�Ź�ʯ��ˮ���Լ�ƿ
C������������Һʱ����������Ͳ�м���һ�������ˮ������������Ũ���Ტ���Ͻ���
D������һ��������ͬ����ֽ��������ƽ���������ϣ���NaOH�����������ֽ�ϳ���
E��NaOH��Һ���ܱ����ڴ��в��������Լ�ƿ��
F������ˮ��ʪ��pH��ֽ����ϡ�����У��ⶨ��Һ��pH
��2����ѧʵ���У�����ȷ�IJ������ʵ������ȷ�����һ����Ӱ�죬������>������<������������д���пհף�
����������ƽ��ȡ10.4 g�Ȼ��ƣ�����������Ȼ��Ƶ�λ�÷ŵߵ��ˣ�����ȡ���Ȼ��Ƶ�����________10.4 g��
��������ƿ����500 mL 0.1 mol��L��1NaOH��Һ������ʱ���ӿ̶��ߣ�������Һ�����ʵ���Ũ��________0.1 mol��L��1��
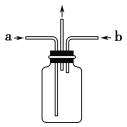
��3��ʵ��ʱΪʹ��������������ͼ��ʾװ���г�ֻ�ϲ���Ӧ����a��ͨ���������_______�����������϶࣬��ƿ�ڻ���ִ������̣��ð���Ϊ___________����Ӧ�ķ���ʽΪ___________����֪��Ԫ�ر��������ɳ����ĵ��ʣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���Ȼ��ơ��Ȼ�狀�̼�������������ʵ��ܽ�����ߣ��������ߵõ�������˵���У���ȷ���ǣ�������
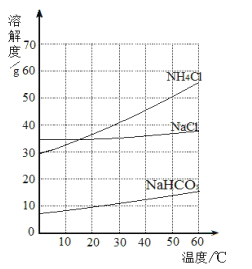
����ȴ����Na+��Cl-��NH4+��HCO3-��Ũ�ȵ���Һ���ɵõ�̼�����ƾ���
����20��ʱ���������ʱ�����Һ��������������ΪNH4Cl��NaCl��NaHCO3
����30��ʱ���Ȼ��ƺ��Ȼ�粒����20g�ֱ�����50gˮ��������Һ���DZ�����Һ
�����ýᾧ�����Ȼ��ơ��Ȼ�炙�����з�����Ȼ�淋�����¶���10������
A. �٢ڢ� B. �٢ڢ� C. �ڢۢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������7.78g̼���ƺ�̼�����ƵĻ���ʹ̼��������ȫ�ֽ⣬���������������2.48g��
(1)ԭ�������̼�����Ƶ�����Ϊ______����Ӧ�Ļ�ѧ����ʽΪ ______________��
(2)��ʣ���������ˮ�����500mL��Һ��������Һ�����ʵ���Ũ��Ϊ______��ȡ������Һ50mL����������ε���0.2mol/L����35mL����ȫ��Ӧ���ڱ�״�������ɶ�����̼�����Ϊ_______mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2�ڹ�ҵ��ũҵ��ҽҩ�϶��й㷺����;��
��1��H2O2�Ƕ�Ԫ���ᣬд����һ���ĵ��뷽��ʽ__���ڶ����ĵ���ƽ�ⳣ������ʽKa2=_________��
��2���������ʶ�������H2O2�ֽ�Ĵ�����һ�ֹ۵���Ϊ���ڷ�Ӧ�����д����ȱ�H2O2��������ԭ�������ֱ�H2O2��ԭ�������������������ʶ�����H2O2�ֽ�Ĵ������ڷ�Ӧ�������ȱ���������ԭ����________��
��I - ��Fe3+ ��Cu2+ ��Fe2+
��3��H2O2��һ�ֻ����Ѻõ�ǿ����������Ʒ�ˮ����Ҫ��Cu2+��Ni2+����������Fe3+��Fe2+��Cr3+�ȣ��Ʊ���������һ���������£�
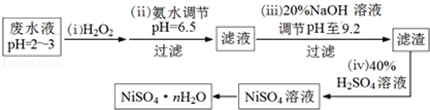
�ٵڣ�������������H2O2��Ӧ�����ӷ���ʽ_________________��
��Ϊ�ⶨNiSO4nH2O����ɣ���������ʵ�飺��ȡ2.627g��Ʒ�����Ƴ�250.00mL��Һ��ȷ��ȡ���Ƶ���Һ25.00mL����0.04000molL��1��EDTA��Na2H2Y������Һ�ζ�Ni2+�����ӷ���ʽΪNi2++H2Y2��=NiY2��+2H+��������EDTA����Һ25.00mL��������������Ļ�ѧʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���þ������ˮú���ڴ���������,��ˮ����������Ӧ��ȡ����,��ѧ����ʽΪCO(g)+H2O(g) ![]() H2(g)+CO2(g)��һ��������,��4 mol CO��2 mol H2O(g)�������Ϊ2 L���ܱ�������,��ϵ�и����ʵ�Ũ����ʱ��ı仯��ͼ��ʾ:
H2(g)+CO2(g)��һ��������,��4 mol CO��2 mol H2O(g)�������Ϊ2 L���ܱ�������,��ϵ�и����ʵ�Ũ����ʱ��ı仯��ͼ��ʾ:
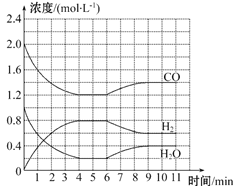
��1����0��4 minʱ��,��Ӧ����v(H2O)Ϊ_______mol��L-1��min-1,�������·�Ӧ��ƽ�ⳣ��KΪ______(������λ��Ч����)��
��2���÷�Ӧ��4 minʱ,CO��ת����Ϊ________��
��3����6 minʱ�ı���ⲿ����Ϊ����,��÷�Ӧ�Ħ�H________0(�>����=����<��),��ʱ��Ӧ��ƽ�ⳣ��________(�������С�����䡱)��
��4���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________��
a.���������ܶȲ��� b.���������c(CO)����
c.v(H2O)��=v(H2)�� d.����2 mol H��O����ͬʱ����1 mol H��H��
��5����������4 minʱ��ͬ���¶�,��һ�ݻ��ɱ���ܱ�������ͬʱ����0.5 mol CO��1.5 mol H2O(g)��0.5 mol CO2��a mol H2,��a=2.5ʱ,������Ӧ��________(�����Ӧ�����淴Ӧ��)������С���Ҫʹ������Ӧ��ʼʱ���淴Ӧ�������,��a��ȡֵ��ΧΪ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�ҽ����������Ƶ��������ܺϽ���������˵���̼���ܽṹ�Ŀɿ��Ʊ����⡣
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ___________������̼���ܿɿ���ʯīϩ��һ������������ɵĿ���Բ���壬��̼ԭ�ӵ��ӻ���ʽΪ_____________��
��2�����ṹ�����ܿ��������½���ȩ��HCHO����ȫ����������֪��ȩ��ԭ�Ӿ������ȶ��ṹ����ȩ������_____________���ӣ�ѡ����ԡ����Ǽ��ԡ����������幹��Ϊ_____________��
��3���Ⱥ�ɫ�����ʻ���[Co2(CO)8]���۵�Ϊ52�棬�����ڶ����л��ܼ����þ�������_____________���塣
��4��Ԫ�������ܡ���������ϵԪ�أ����ʾ��������ԡ�ij����������ṹ��ͼ��ʾ�������ڵ������������ܺ���_____________������ţ���
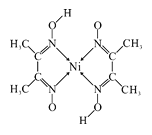
A���Ӽ� B���ۼ� C������ D��λ�� E���
��5����Ϊ�۵���ߵĽ�����Ӳ�ȼ����侧���ṹ��ͼ��ʾ����֪�ٵ�Ħ������ΪM g/mol����ԭ�ӵİ뾶Ϊa pm�����ٵ��ܶ�Ϊ����_____________g��cm-3����ֻ���г�����ʽ�����軯��
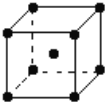
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫϡ��ҺX�У����ܺ���������������е�ij���֡�
������ | CO |
������ | Al3����Fe3����Mg2����NH |
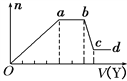
ȡ����Һ�����������м���ij�Լ�Y���������������ʵ���(n)������Լ����(V)�Ĺ�ϵ��ͼ��ʾ��
��1����Y�����ᣬ����Һ�к��е���������______ ��ab�η�����Ӧ�������ӷ���ʽΪ____________, Oa���ϱ��вμӷ�Ӧ�����ӵ����ʵ���֮��Ϊ________________________��
[Ҫ�������ӷ��ţ���n��Fe3+��]��
��2����Y��NaOH��Һ����X��һ�������ϱ��е�������________________________�����ǵ����Ӹ�����Ϊ______________________________��[����������ǰ���������ں���ǰ���ͼ��ں��˳������]��ab�η�Ӧ�����ӷ���ʽΪ______________________________�� bc�η�Ӧ�����ӷ���ʽΪ____________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com