
| A. | AlCl3溶液中加入过量氨水 | B. | Al2(SO4)3溶液中加入过量KOH溶液 | ||
| C. | MgCl2溶液中加入过量氨水 | D. | MgSO4溶液中加入过量KOH溶液 |
分析 A.氯化铝和氨水反应生成Al(OH)3,Al(OH)3不溶于弱碱;
B.Al(OH)3能溶于强碱KOH溶液;
C.Mg(OH)2不溶于氨水溶液;
D.Mg(OH)2不溶于碱溶液.
解答 解:A.氯化铝和氨水反应生成Al(OH)3,Al(OH)3不溶于弱碱,氨水溶于弱碱溶液,所以有白色沉淀生成,故A不选;
B.Al(OH)3能溶于强碱KOH溶液,铝离子和KOH反应先生成氢氧化铝沉淀,当KOH过量时氢氧化铝溶于KOH溶液导致最终没有白色沉淀,故B选;
C.氯化镁和一水合氨反应生成氢氧化镁沉淀,Mg(OH)2不溶于氨水溶液,所以最终有白色沉淀生成,故C不选;
D.硫酸镁和KOH反应生成氢氧化镁沉淀,Mg(OH)2不溶于碱溶液,所以最终有白色沉淀生成,故D不选;
故选B.
点评 本题考查镁铝化合物,侧重考查学生元素化合物知识,明确物质性质是解本题关键,注意:氢氧化铝不溶于弱碱但能溶于强碱溶液,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,由水电离出的c(H+)=l0-14mo1•L-1的溶液中:CO32-、SO42-、Na+、K+ | |
| B. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、CN- | |
| C. | pH为1的溶液:Ca2+、Na+、Mg2+、NO3- | |
| D. | 与铝反应放出氢气的溶液:Fe2+、SO42-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含酚酞的氢氧化钠溶液 | B. | 品红溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 溴的四氯化碳溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸钠是常用的防腐剂 | |
| B. | 婴儿食品可添加着色剂,以增加婴儿对食物的兴趣 | |
| C. | 食用盐既可以做防腐剂,又可以做调味剂 | |
| D. | 药物可以帮助我们战胜疾病,但我们仍需合理用药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氯化铁可用作净水剂,是因为氢氧化铁胶体具有吸附性 | |
| B. | 氢氧化铁胶粒直径在10-9一10-7m之间 | |
| C. | 氯化铁溶液转变成氢氧化铁胶体是化学变化,氢氧化铁胶体变成氢氧化铁沉淀是物理变化 | |
| D. | 氢氧化铁胶体的分散质是氢氧化铁分子,分散剂是水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.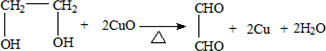 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com