
一定条件下反应2AB(g)⇌A2(g)+B2(g)达到平衡状态的标志是( )
|
| A. | 单位时间内生成3n molA2,同时消耗2n molAB |
|
| B. | 容器内,3种气体AB、A2、B2共存 |
|
| C. | AB的消耗速率等于A2的消耗速率 |
|
| D. | 容器中各组分的物质的量分数不随时间变化 |
考点:
化学平衡状态的判断.
专题:
化学平衡专题.
分析:
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:A、单位时间内生成3n molA2,相当于消耗6n molAB,同时消耗2n molAB,没有达到平衡状态,故A错误;
B、容器内,3种气体AB、A2、B2共存,未平衡时也是三者共存的体系,故B错误;
C、AB的消耗速率,相当于一半A2的生成速率等于A2的消耗速率,正逆反应速率不等,故C错误;
D、容器中各组分的物质的量分数不随时间变化,说明反应达到平衡状态,故D正确;
故选D.
点评:
本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:

将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
(1)装置I中①中的反应方程式为 ②中离子方程式为 .
(2)①中长导管的作用是 .
(3)烧瓶中生成的红褐色油状液滴的成分是 ,要想得到纯净的产物,可用 试剂洗涤.洗涤后分离粗产品应使用的仪器是 .
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.
a的作用是 .
b中的试剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于常见有机物的说法中,正确的是( )
|
| A. | 汽油、苯、乙醇都属于烃类物质 |
|
| B. | 含5个碳原子的有机物,分子中最多可形成5个碳碳单键 |
|
| C. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 |
|
| D. | 二氧化硫和乙烯都能使溴水褪色,二者反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 |
|
| B. | 凡是在加热或点燃条件下进行的反应都是吸热反应 |
|
| C. | 表明反应所放出或吸收热量的化学方程式叫做热化学方程式 |
|
| D. | 氢气在氧气中燃烧的热化学方程式是:2H2(g)+O2(g)═2H2O(l);△H=﹣483.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
2H2(g)+O2(g)═2H2O(l);△H=﹣571.6kJ•mol﹣1
CO(g)+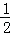 O2(g)═CO2(g);△H=﹣283.0kJ•mol﹣1
O2(g)═CO2(g);△H=﹣283.0kJ•mol﹣1
C8H18(l)+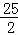 O2(g)═8CO2(g)+9H2O(l);△H=﹣5518kJ
O2(g)═8CO2(g)+9H2O(l);△H=﹣5518kJ
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=﹣802.3kJ•mol﹣1
其中反应热能表示该物质燃烧热的是( )
|
| A. | H2 | B. | CO | C. | C8H18 | D. | CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有相同pH的三种酸HX、HY、HZ的溶液,稀释相同倍数后,pH的变化值依次增大,则HX、HY、HZ的酸性由强到弱的顺序是( )
|
| A. | HX、HY、HZ | B. | HZ、HY、HX | C. | HX、HZ、HY | D. | HY、HZ、HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于下列反应:2SO2+O2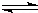 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 .如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L•min),那么2min时SO2的浓度为 .
2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 .如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L•min),那么2min时SO2的浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
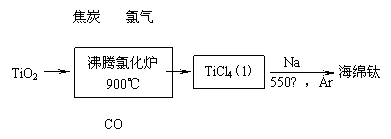

① 沸腾氯化炉中发生的主要反应为: 。
② 已知:Ti(s) +2Cl2(g)=TiCl4(l) ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s) ΔH=b kJ·mol-1;
Na(s)=Na(l) ΔH=c kJ·mol-1;
则:TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s) ΔH= kJ·mol-1。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如下图所示,二氧化钛电极连接电源 极,该极电极反应为:
。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种无毒的还原性气体,该气体是 。


(3)海绵钛可用碘提纯,原理为: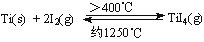 ,下列说法正确的是 。
,下列说法正确的是 。
A.该反应正反应的ΔH>0
B.在不同温度区域,TiI4的量保持不变
C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
D.在提纯过程中,I2 可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组反应中,不能用同一个离子方程式表示的是()
A. 盐酸分别与NaOH溶液、Ca(OH)2溶液反应
B. 锌分别与稀盐酸、稀硫酸反应
C. 硝酸分别与Na2CO3溶液、K2CO3溶液反应
D. 硫酸分别与NaOH溶液、Ba(OH)2溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com