
| A. | 钠的多 | B. | 铁的多 | ||
| C. | 铁和钠放出一样多 | D. | 无法比较 |
分析 Fe与盐酸发生反应:Fe+2HCl=FeCl2+H2↑,计算Fe、HCl的物质的量,进行过量计算,根据不足量的物质计算生成氢气的物质的量;
Na与盐酸反应,2Na+2HCl=2NaCl+H2↑,盐酸不足,发生反应2Na+2H2O=2NaOH+H2↑,根据关系式2Na~H2↑,计算生成氢气的物质的量,
相同条件下,体积之比等于物质的量之比,以此解答该题.
解答 解:n(HCl)=0.1L×1mol/L=0.1mol,
n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,
n(Na)=$\frac{4.6g}{23g/mol}$=0.2mol,
Fe+2HCl=FeCl2+H2↑,盐酸不足,生成氢气0.05mol,
Na与盐酸反应,2Na+2HCl=2NaCl+H2↑,盐酸不足,发生反应2Na+2H2O=2NaOH+H2↑,由关系式2Na~H2↑,可知生成氢气的物质的量为0.1mol,
则钠生成氢气多,
故选A.
点评 本题考查根据方程式的计算,侧重于学生的分析能力和计算能力的考查,涉及过量计算,难度不大,注意Na与酸的反应,盐酸不足时Na与水反应.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:解答题
 某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)
某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)| 实验编号 | 水果种类 | 电极间距离 | 电流大小/μA |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹果 | 2 | 27.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
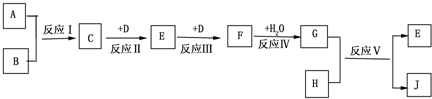
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物不可能含有共价键 | B. | 构成晶体的粒子一定含有共价键 | ||
| C. | 共价化合物中不可能含有离子键 | D. | 分子中一定含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +CH3CH2OH$\stackrel{H+}{→}$
+CH3CH2OH$\stackrel{H+}{→}$ +H2O,
+H2O, ;
; ,则H的结构简式是
,则H的结构简式是 .高聚物L由H通过肽键连接而成,写出生成L的方程式n
.高聚物L由H通过肽键连接而成,写出生成L的方程式n →nH2O+
→nH2O+ (或
(或 ),.
),.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
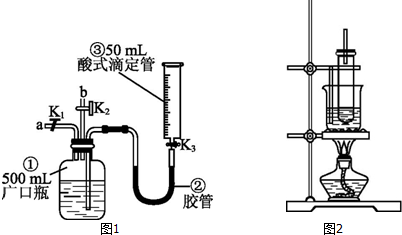
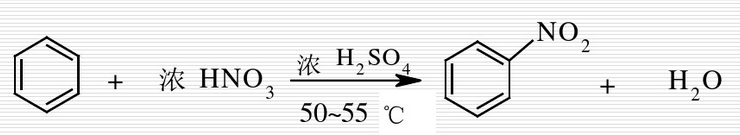 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com