
| 实验1 | 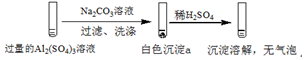 |
| 实验2 | 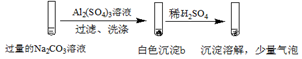 |
| A. | 实验1中,白色沉淀a是Al(OH)3 | |
| B. | 实验2中,白色沉淀b含有CO32- | |
| C. | 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关 | |
| D. | 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液 |
分析 实验1在过量的硫酸铝溶液中加入碳酸钠溶液,过滤、洗涤,得到的沉淀a加入稀硫酸,沉淀溶解,没有气泡,可说明沉淀a含有Al(OH)3,
实验2在过量的碳酸钠溶液中加入硫酸铝溶液,过滤、洗涤,得到沉淀b,加入稀硫酸,沉淀溶解,并有少量气泡,沉淀b中含有Al(OH)3,并含有碳酸盐,以此解答该题.
解答 解:A.由以上分析可知实验1中,白色沉淀a是Al(OH)3,故A正确;
B.实验2中有气泡生成,该气体为二氧化碳,可说明白色沉淀b含有CO32-,故B正确;
C.实验1、2中,加入试剂顺序不同,生成的沉淀的pH不同,生成沉淀不同,可说明与pH有关,故C错误;
D.检验沉淀是否洗涤干净,可通过检验硫酸根离子的方法,即用盐酸酸化的BaCl2溶液,观察是否有沉淀生成,故D正确.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,侧重考查学生的分析能力和实验能力的考查,注意把握物质的性质以及实验现象的分析,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 焰色反应前用硫酸洗涤铂丝 | |
| B. | 用硫酸干燥Cl2、HCl、CO2、H2 | |
| C. | 用盐酸酸化KMnO4溶液滴入FeSO4溶液,证明Fe2+具有还原性 | |
| D. | 先加硝酸酸化,再加BaCl2溶液检验未知溶液中的SO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
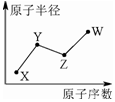 X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | Y、W的最简单氢化物的水溶液能相互反应生成离子化合物 | |
| C. | 非金属性:Y>Z | |
| D. | X、Z、W形成的化合物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | 第三 | ||
| 3d54s1 | ⅥB |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾既可用作净水剂,也可用作消毒剂 | |
| B. | 小苏打、氢氧化铝都可用于治疗胃酸过多 | |
| C. | 煤的干馏、石油的分馏都属于化学变化 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米(1微米=1000纳米)的颗粒物,则PM2.5在空气中能形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
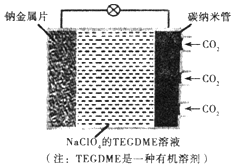 我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )| A. | 充电时,Na+从阳极向阴极移动 | |
| B. | 可以用乙醇代替TEGDME做有机溶剂 | |
| C. | 放电时,当转移lmol电子负极质量减轻23g | |
| D. | 放电时,正极反应为3CO2+4Na++4e-=2Na2CO3+C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
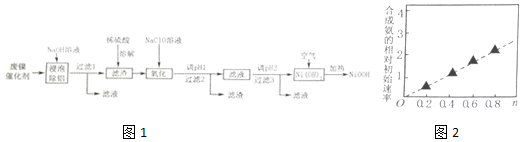
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y和其它四种元素均可形成至少两种化合物(两种元素组成) | |
| B. | 原子半径由大到小排列的顺序是:R>W>Z>Y>X | |
| C. | 在Z、Y形成的两种离子化合物中阴阳离子的个数比均为2:1 | |
| D. | Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com