
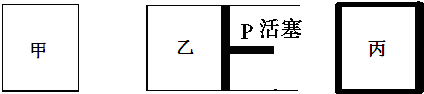
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 1 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | N2的转化率:丙是甲的二倍 | |
| B. | 三个容器内反应的平衡常数:甲=乙>丙 | |
| C. | 达平衡时氨气的体积分数:甲>乙>丙 | |
| D. | 放出热量关系:b<a<92.4 |
分析 A、相同温度下,在体积相等的密闭容器,甲为恒温恒容容器,丙为恒容绝热容器,丙的起始物质的量为甲的两倍,该反应是气体体积减小的放热反应,平衡时丙的压强大于甲,丙的温度大于甲,根据压强、温度对平衡的影响判断;
B、平衡常数随温度变化,不随浓度改变;
C、甲为恒温恒容容器,乙为恒温恒压容器,起始量相同,该反应气体体积减小的放热反应,达到平衡时乙的压强大于甲,则乙是氨的体积分数大于甲,据此判断;
D、反应是可逆反应不能进行彻底,焓变是对应化学方程式的物质完全反应放出的热量.
解答 解:A、相同温度下,在体积相等的密闭容器,甲为恒温恒容容器,丙为恒容绝热容器,丙的起始物质的量为甲的两倍,该反应是气体体积减小的放热反应,平衡时丙的压强大于甲,N2的转化率增大,丙的温度大于甲,N2的转化率减小,所以无法判断N2的转化率的关系,故A错误;
B、甲为恒温恒容容器,乙为恒温恒压容器、丙为恒容绝热容器,该反应是气体体积减小的放热反应,则丙的温度高于甲乙,平衡常数随温度变化,不随浓度改变,所以化学平衡常数为甲=乙>丙,故B正确;
C、甲为恒温恒容容器,乙为恒温恒压容器,起始量相同,该反应气体体积减小的放热反应,达到平衡时乙的压强大于甲,则乙是氨的体积分数大于甲,故C错误;
D、N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.焓变是指1mol氮气和3mol氢气全部反应放出的热量;①起始量反应不能全部转化所以a<92.4KJ,②起始量相当于在①中加入了1mol氮气,所以平衡正向进行反应放出的热量b>a,但是反应是可逆反应不能进行彻底所以b<92.4KJ,故放出热量关系:a<b<92.4,故D错误;
故选B.
点评 本题考查化学平衡知识应用(判断平衡状态、图象分析、平衡移动原理、平衡计算);考题主要有两类形式:第一类考查平衡的一般问题,如化学反应速率的表示(计算)、化学平衡图象的分析、平衡常数的大小比较及相关计算.回答化学反应速率时重点留意是否为浓度的改变量.平衡常数的大小比较,关键两者的温度高低.第二类为等效平衡的相关判断.


科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ①④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定等于0.1mol/L | B. | 一定大于0.1mol/L | ||
| C. | 一定小于0.1mol/L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.022mol•L-1 | B. | 0.045mol•L-1 | C. | 0.8mol•L-1 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.2 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 0~t1 min内的平均反应速率v(H2)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 平衡时CO的转化率为66.67% | |
| C. | t1时刻该反应处于平衡状态 | |
| D. | t2时刻CO的浓度为0.8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | 100mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA | |||||||||||
| C. | 已知:
 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com