
| A. | 气态氢化物水溶液的酸性依次减弱 | |
| B. | 氯水、溴水、碘水都能使淀粉碘化钾试纸变蓝 | |
| C. | 气态氢化物的稳定性随原子序数的增大而增强 | |
| D. | 原子核外最外层电子数随原子序数的增大而增多 |
分析 A.卤素氢化物水溶液酸性逐渐增强;
B.氯气和溴具有强氧化性,能和碘离子发生氧化还原反应生成碘,碘水中含有碘,碘遇淀粉试液变蓝色;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.同一主族元素,最外层电子数相等.
解答 解:A.随着原子序数增大,卤族元素原子核吸引电子能力逐渐减小,所以其氢化物在水溶液中电离程度逐渐增大而导致其水溶液酸性增强,故A错误;
B.氯气和溴具有强氧化性,能和碘离子发生氧化还原反应生成碘,碘水中含有碘,碘遇淀粉试液变蓝色,所以氯水、溴水、碘水都能使淀粉碘化钾试纸变蓝,故B正确;
C.元素的非金属性越强,其氢化物的稳定性越强,卤族元素非金属性随着原子序数增大而减弱,所以其氢化物的稳定性随着原子序数增大而减弱,故C错误;
D.同一主族元素,最外层电子数相等,所以卤族元素原子最外层电子数相等,故D错误;
故选B.
点评 本题以卤素为例考查同一主族元素原子结构、性质递变规律,侧重考查氢化物的稳定性、氢化物水溶液酸性、单质的氧化性等知识点,知道非金属性强弱判断方法,易错选项是A.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
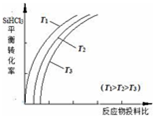 含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
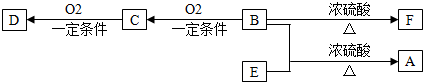
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
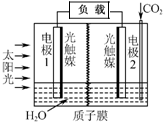 利用人工模拟光合作用合成甲酸的原理为:
利用人工模拟光合作用合成甲酸的原理为:| A. | 电极1周围pH增大 | |
| B. | 电子由电极1经过负载流向电极2 | |
| C. | 电极2的反应式:CO2+2H++2e-=HCOOH | |
| D. | 该装置能将太阳能转化为化学能和电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O+2F2═4HF+O2 | B. | H2O+3NO2═2HNO3+NO | ||
| C. | 3H2O+P2O5═2H3PO4 | D. | H2O+Si+2NaOH═2H2↑+Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )
X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )| A. | 简单离子的半径:X3+>Z3- | |
| B. | 元素Z的最外层电子可能为6 | |
| C. | 元素Y的最高价氧化物的水化物可能是强酸 | |
| D. | 元素W的最高价氧化物的水化物属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).
Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).| 气化炉 | 燃烧炉 |
| ①C(s)+H2O(g)?CO(g)+H2(g)△H=+131.6kJ•mol-1 ②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1 ③CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ•mol-1 | ④C(s)+O2(g)═CO2(g) △H=-393.8kJ•mol-1 ⑤CaCO3(s)?CaO(s)+CO2(g) K |
 | 0 | 5 | 10 | 15 | 20 | 25 |
| T1 | 0 | 1.5 | 2.3 | 4.0 | 4.0 | 4.0 |
| T2 | 0 | 1.0 | 1.8 | 2.8 | 3.1 | 3.1 |
 | 0 | 5 | 10 | 15 | 20 | 25 |
| p1 | 1 | 0.90 | 0.83 | 0.75 | 0.75 | 0.75 |
| p2 | 1 | 0.58 | 0.35 | 0.31 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
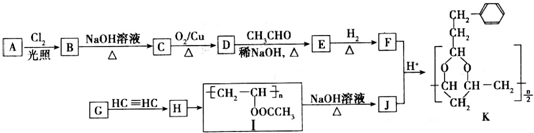
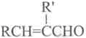 +H2O(R,R′表示烃基或氢)
+H2O(R,R′表示烃基或氢)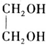 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$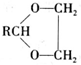 +H2O
+H2O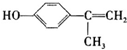 (写结构简式).
(写结构简式).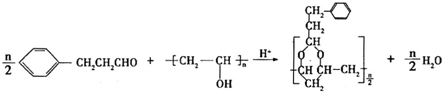 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升华 溶解 过滤 蒸发 | B. | 溶解 过滤 萃取 分液 | ||
| C. | 加热 溶解 过滤 结晶 | D. | 溶解 过滤 分馏 结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com