
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于10.2 | 样品含NaOH |
分析 (1)①根据二氧化硫具有还原性、漂白性分析;
②减缓二氧化硫的流速,适当升高温度,均能使二氧化硫充分反应;
(2)①根据检验氯离子的方法分析;
②NaOH的碱性强,可以通过测定pH来确定是否有NaOH;
(3)根据KIO3的量求出I2,再根据S2O32-与I2的关系求出Na2S2O3的物质的量及浓度.
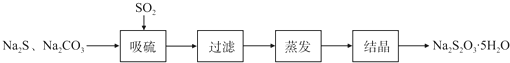
解答 解:(1)①二氧化硫具有还原性、漂白性,所以可以用品红、溴水或KMnO4溶液,来检验二氧化硫是否被完全吸收,若SO2吸收效率低,则二氧化硫有剩余,B中的溶液会褪色,故答案为:品红、溴水或KMnO4溶液;溶液颜色很快褪色;
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,可以减缓二氧化硫的流速,使二氧化硫与溶液充分接触反应,适当升高温度,也能使二氧化硫充分反应,故答案为:控制SO2的流速;适当升高温度;
(2)实验所用的Na2CO3含少量NaCl、NaOH,若检验NaCl存在,需先加稀硝酸排除干扰,再加硝酸银溶液,若有白色沉淀生成,说明有NaCl;已知室温时CaCO3饱和溶液的pH=10.2,若要检验氢氧化钠存在,需加入过量CaCl2溶液,把Na2CO3转化为CaCO3,再测量溶液的pH,若pH大于10.2,说明含有NaOH,
故答案为:
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 有白色沉淀生成 | ||
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. |
点评 本题以硫的化合物的性质为载体,考查氧化还原滴定的应用、实验基本操作、化学计算等,难度中等,是对知识的综合运用与分析解决问题能力的考查,注意利用关系式进行计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠与CuSO4溶液反应:2Na+Cu=Cu↓+2Na+ | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
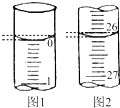 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:| 滴定次数 | 0.1000mol-L-1盐酸的体积/mL | ||
| 滴定前 | 滴定后 | 体积/mL | |
| 1 | 0.10 | 26.21 | 26.11 |
| 2 | 1.56 | 31.30 | 29.74 |
| 3 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
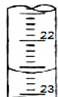 Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开反应釜,将Na 暴露在空气中与氧气反应 | |
| B. | 向反应釜通入Cl2,Na 在Cl2中燃烧生成NaCl | |
| C. | 向反应釜加大量H2O,通过化学反应“除掉”金属钠 | |
| D. | 向反应釜滴加C2H5OH,并设置放气管,排出氢气和热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
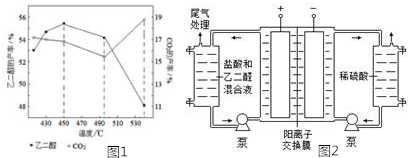
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯( )的一氯代物 )的一氯代物 | D. | 立体烷(  )的二氯代物 )的二氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
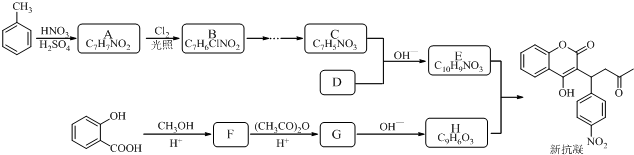
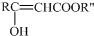
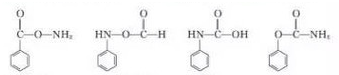
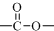 结构;
结构;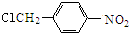 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$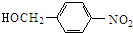 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$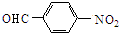
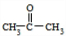 ;E
;E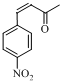
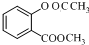 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$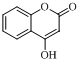 +CH3OH.
+CH3OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com