
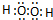 .
.分析 短周期元素中,由③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,则A处于IA族,B的离子半径最小,则B为金属元素,由④中A与B质子数之和是D质子数的3倍,则A、B只能处于第三周期,可知A为Na,B为Al,则D的质子数为$\frac{11+13}{3}$=8,故D为O元素;由①热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据②Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素,以此解答该题.
解答 解:短周期元素中,由③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,则A处于IA族,B的离子半径最小,则B为金属元素,由④中A与B质子数之和是D质子数的3倍,则A、B只能处于第三周期,可知A为Na,B为Al,则D的质子数为$\frac{11+13}{3}$=8,故D为O元素;由①热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据②Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素.
(1)HmDm为H2O2,电子式为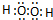 ,故答案为:
,故答案为: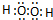 ;
;
(2)由于非金属性Cl>S,单质的氧化性Cl2>S,单质的氧化性越强,对应阴离子的还原性越弱,则有还原性:S2->Cl-,可通过反应Cl2+S2-=2Cl-+S↓证明,
故答案为:Cl2+S2-=2Cl-+S↓;
(3)E的单质为氯气,A与D形成的化合物的水溶液为NaOH溶液,在常温下氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
常温下,将等物质的量浓度的H2S溶液和NaOH溶液等体积混合,该反应的离子方程式为H2S+OH-=HS-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;H2S+OH-=HS-+H2O.
点评 本题考查位置结构性质的关系及应用、常用化学用语、元素化合物性质等,正确推断元素的种类为解答该题的关键.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 能使紫色石蕊变红 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 该有机物不能与NaOH发生反应 | |
| D. | 1mol该有机物只能与1mol Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3 熔点高,可用于制作耐高温仪器 | |
| B. | 水果、蔬菜等是碱性食物 | |
| C. | 高纯度的硅单质可用于制作光导纤维 | |
| D. | 绿色化学的核心是从源头上杜绝污染的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

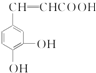 跟碳酸氢钠:
跟碳酸氢钠: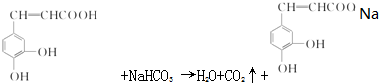 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用水鉴别乙醇、苯和溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
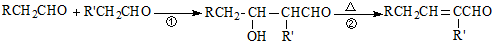

 ,B
,B .
. +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$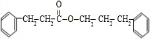 +H2O.
+H2O.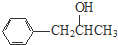 、
、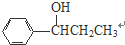 、
、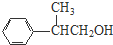 、
、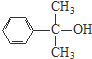 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
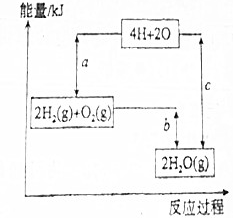
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com