
由下列实验事实得出结论错误的是
A.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性
B.浓硫酸可用作气体干燥剂,说明浓硫酸具有吸水性
C.铜与浓硫酸共热有刺激性气味气体放出,说明浓硫酸具有强氧化性
D. SO2能使紫红色的酸性高锰酸钾溶液褪色,说明SO2具有漂白性
科目:高中化学 来源: 题型:
向100 mol FeBr2的溶液中,通入3 mol Cl2 。反应后溶液中Br-和Cl-的物质的量浓度相等,则溶液中发生反应的离子方程式为 ( )
A.2Fe2++Cl2 = 2Fe3++2Cl-
B.2Br-+Cl2 = Br2+2Cl-
C.4Fe2++2Br-+3Cl2 = Br2+4Fe3++6Cl-
D.2Fe2++4Br-+3Cl2 = 2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:


已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为 ___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____ ____。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)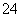 聚合离子。该水解反应的离子方程式为____________________________。
聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO 。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料。从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:


(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为
。
(2)取少量浸取液,滴加KSCN溶液后呈血红色,说明溶液中存在 离子(填写离子符号),检验溶液中还存在Fe2+的方法是 (写明步骤、试剂和现象)。
(3)浸取液与铁屑反应的离子方程式为 ;X(晶体)的化学式为 。
(4)第③步反应化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中各阳离子的浓度相同(不 考虑溶液中离子的变化),且SO42-的物质的量浓度为6mol ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为
A.5.6g B.11.2 g C.22.4g D.33.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸氢铵、硫酸铵均是我国主要的氮肥品种,碳酸氢铵在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
I.某学生欲测定碳酸氢铵化肥中的含氮量,选用下列装置通过测定生成二氧化碳的量间接测出化肥的含氮量。

(1)请选择必要的装置(每个装置最多使用一次),按气流方向连接顺序为_______________组装好装置,连在最后的装置起到的作用
(2) 检验气密性后,将样品放入圆底烧瓶中,滴加液体。该液体最适合的是_________________.
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化纳
II.如果氮肥中成分是硫酸铵,则可以用甲醛法测定含氮量,反应为:
2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4再将生成的酸用氢氧化钠标准溶液滴定,从而测出氮的含量。步骤如下:
(3)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加蒸馏水溶解配成100mL溶液,准确量取20.00mL的待测液溶液于锥形瓶中,加入适量l8%的中性甲醛,放置5min后,加入1-2滴_______指示剂(已知滴定终点的pH约为8.8),用浓度为0.0800mol/L氢氧纯钠标准溶液滴定至终点。再重复滴定2次,三次滴定的读数如下表:
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
计算出该样品中的氮的质量分数为_______________。
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值________(填”偏大“偏小”或“无影响”)。
(5)如果测定碳酸氢铵化肥中的含氮量时,也使用甲醛法是否合理____________(填“是”或“否”),理由是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com