
��֪���� S(��б��s)��O2(g) === SO2(g) ��H1����297.16 kJ��mol-1
�� S(������s)��O2(g) === SO2(g) ��H2����296.83 kJ��mol-1
�� S(���s) === S(������s) ��H3
����˵����ȷ���ǣ� ��
A����H3����0.33 kJ��mol-1��������
B����б��ת��Ϊ������ķ�Ӧ�����ȷ�Ӧ
C��S����б��s��=== S��������s�� ��H3��0��������ȵ�б���ȶ�
D��S����б��s��=== S��������s�� ��H3��0����б����������ȶ�
 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ij�����Ƿ������ʱ����������ȡ�����������Թ��У��������IJ����� ( )
A�����ռ���Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ���ڹܿڼ���
B��ֱ�Ӽ��ȣ���ʪ��ĺ�ɫʯ����ֽ���ڹܿڼ���
C�����ռ���Һ�����ȣ����Թ��еμ���ɫʯ����Һ
D����ˮ�ܽ⣬�μ���ɫ��̪��Һ�����Ƿ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����һ������ˮ��Һ��ֻ���ܺ������������е������֣�������ˮ�ĵ��룩��K����NH ��Cl����Mg2����Ba2����CO
��Cl����Mg2����Ba2����CO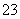 ��SO
��SO ����ȡ����100mL��Һ��������ʵ�飺��1����һ�ݼ���AgNO3��Һ�г�����������2���ڶ��ݼ�����NaOH��Һ���Ⱥ��ռ�����״��������896ml������ȫ���ݳ�������3�������ݼ�����BaCl2��Һ
����ȡ����100mL��Һ��������ʵ�飺��1����һ�ݼ���AgNO3��Һ�г�����������2���ڶ��ݼ�����NaOH��Һ���Ⱥ��ռ�����״��������896ml������ȫ���ݳ�������3�������ݼ�����BaCl2��Һ
�ø������6.63g������������ϴ�ӡ������������4.66g����������ʵ�飬
�����Ʋ���ȷ����
A�� K��һ������ B�� 100 mL��Һ�к�0.02 mol CO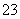
C�� Cl��һ������ D�� Ba2��һ�������ڣ�Mg2�����ܴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�Ȼ�ѧ����ʽ��2SO2(g)��O2(g)2SO3(g)����H����Q kJ��mol��1(Q��0)������˵����ȷ���� (����)��
A����ͬ�����£�2 mol SO2(g)��1 mol O2(g)�����е�����С��2 mol SO3(g)
���������
B����2 mol SO2(g)��1 mol O2(g)����һ�ܱ������г�ַ�Ӧ�ų�����Ϊ
Q kJ
C������ѹǿ�������¶ȣ��÷�Ӧ���̷ų����������
D���罫һ����SO2(g)��O2(g)����ij�ܱ������г�ַ�Ӧ�����Q kJ����˹�������2 mol SO2(g)������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������Ȼ�ѧ����ʽ������C(s)��ȼ���ȡ�H���� �� ��
C(s) + H2O(l) === CO(g) + H2(g)�� ��H1 ==175.3kJ��mol��1
2CO(g) + O2(g) == 2CO2(g)�� ��H2 == ��566.0 kJ��mol��1
2H2(g) + O2(g) == 2H2O(l)�� ��H3 == ��571.6 kJ��mol��1
A. ��H1 + ��H2 ����H3 B.2��H1 + ��H2 + ��H3
C. ��H1 + ��H2/2 + ��H3 D. ��H1 + ��H2/2 + ��H3/2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��(1)Fe2O3(s) �� C(s)===
C(s)=== CO2(g)��2Fe(s)����H1����234.1 kJ��mol��1
CO2(g)��2Fe(s)����H1����234.1 kJ��mol��1
(2)C(s)��O2(g)===CO2(g)����H2����393.5 kJ��mol��1
��2Fe(s)�� O2(g)===Fe2O3(s) �Ħ�H��(����)������������������������������������
O2(g)===Fe2O3(s) �Ħ�H��(����)������������������������������������
A����824.4 kJ��mol��1 B����627.6 kJ��mol��1
C����744.7 kJ��mol��1 D����169.4 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������X��Һ�ֱ�����ĸ�ʢ��10 mL 2 mol��L��1������ձ��У�����ˮϡ�͵�50 mL����ʱ��X�����ᷢ����Ӧ�����з�Ӧ����������(����)
A��10�� 20 mL 3 mol��L��1��X��Һ
B��20�� 30 mL 2 mol��L��1��X��Һ
C��20�� 10 mL4 mol��L��1��X��Һ
D��10�� 10 mL 2 mol��L��1��X��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�����£�N2(��)��H2(��)����2mol NH3(��)�ų�92.4 kJ���������мס��������ݻ���ͬ���ܱ��������ڳ����£������ܱ���������ͨ��1 molN2��3 mol H2���ﵽƽ��ʱ�ų�����Q1kJ�������ܱ���������ͨ��0.5 mol N2��1.5 mol H2���ﵽƽ��ʱ�ų�����Q2kJ�������й�ϵʽ��ȷ���ǣ� ��
A��Q1=2Q2=92.4 B��Ql>2Q2 C��Q1<2Q2 D��Q1=2Q2��92.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±��г���3��ȼú����������ԭ����

��1�� �������а�ˮ����ȼú������ �Ļ�ѧ��ӦΪ��
�Ļ�ѧ��ӦΪ��


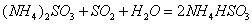
�����ȼú������ ȥ���ʵĴ�ʩ�� �� ������ĸ����
ȥ���ʵĴ�ʩ�� �� ������ĸ����
A������ˮŨ��
B.���߷�Ӧ�¶�
C.ʹȼú�����백ˮ��ֽӴ�
D. ͨ�����ʹ ת��Ϊ
ת��Ϊ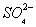
���� ��������������ҪԤ�ȳ�ȥȼú�����д�����
��������������ҪԤ�ȳ�ȥȼú�����д����� ��ԭ�������������ӷ���ʽ��ʾ����
��ԭ�������������ӷ���ʽ��ʾ����
��2�� ��������Ҫ���������з�Ӧ��
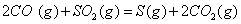








 ��
�� ��Ӧ����
��Ӧ���� ���Ȼ�ѧ����ʽΪ ��
���Ȼ�ѧ����ʽΪ ��
��3�� ���������ö��Ե缫��� ��Һ��װ��
��Һ��װ��
����ͼ��ʾ���������ų�����ijɷ�Ϊ  ��
��
���ѧʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com