
| c(H+) |
| c(CH3COOH) |
| A、加大量稀的食盐溶液 |
| B、降低温度 |
| C、加少量冰醋酸 |
| D、加少量烧碱溶液 |
| c(H+) |
| c(CH3COOH) |
| c(H+) |
| c(CH3COOH) |
| c(H+) |
| c(CH3COOH) |
| c(H+) |
| c(CH3COOH) |


科目:高中化学 来源: 题型:
| A、Na2O和Na2O2的混合物共1mol,阴离子数目在NA~2NA 之间 |
| B、常温常压下,92 g NO2和N2O4的混合气体中含有的分子数目为2NA |
| C、一定条件下,密闭容器充入1molN2和3molH2充分反应,转移电子的数目为6NA |
| D、FeCl3溶液中,若Fe3+数目为NA,则Cl-数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 g H218O含有的中子数为5NA |
| B、1 mol羟基(-OH)含有的电子数为10NA |
| C、1 mol 氯气参加反应时,电子转移数目一定为2NA |
| D、标准状况下,11.2L己烷含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、苯酚钠溶液中通入少量CO2: -O-+CO2+H2O→ -O-+CO2+H2O→ -OH+HCO3- -OH+HCO3- | ||
| B、硫化钠的水解:S2-+2H2O?H2S+2OH- | ||
C、醋酸钡溶液和硫酸反应:Ba2++S
| ||
| D、氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| OH- |
| H+ |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、正常人体血液中,HCO3-的水解程度大于电离程度 |
| B、人体血液酸中毒时,可注射NaHCO3溶液缓解 |
| C、pH=7.00的血液中,c(H2CO3)<c(HCO3-) |
| D、pH=7.40的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、Br-、SiO32- |
| B、H+、Fe2+、SO42-、Cl2 |
| C、K+、Ba2+、Cl-、NO3- |
| D、K+、Ag+、NH3?H2O、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
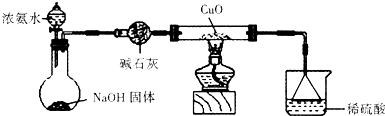
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com