
【题目】将足量CO2气体通入下列物质的水溶液中,始终没有明显现象的是
A. CaCl2 B. Ba(OH)2 C. Ca(ClO)2 D. Na2SiO3
科目:高中化学 来源: 题型:
【题目】升高温度时,化学反应速率加快,主要是由于
A. 分子运动速率加快,使反应物分子间的碰撞机会增多
B. 反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
C. 该化学反应的过程是放热的
D. 该化学反应的过程是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是重要的有机合成中问体,以A为原料合成香料M和线型高分子树脂N的路线如图所示(部分反应条件和物质略去):

已知:
①A是芳香烃的含氧衍生物,其蒸气密度是相同条件下氢气密度的54倍。
②有机物分子中,同一个碳原子上连接两个—OH不稳定,会自动失水。
③ (R、R′表示烃基或氢原子)。
(R、R′表示烃基或氢原子)。
请回答:
(1)A的化学名称为________。N的结构简式为________。
(2)D中含氧官能团的名称为________。C的分子中最多有________个原子共平面。
(3)B→C时,第一步转化的反应类型为________。
(4)E→M的化学方程式为________。
(5)L是D的一种同系物,比D少1个碳原子且存在顺反异构;核磁共振氢谱中有6种吸收峰。则L的顺式结构简式为________。
(6)同时满足下列条件的E的同分异构体有________种(不考虑立体异构),任写其中一种的结构简式________。
①苯环连有两个取代基
②能发生银镜反应
③能与NaHCO3反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读明代爱国诗人于谦的诗《石灰吟》,回答问题:
千锤万凿出深山,烈火焚烧若等闲.粉身碎骨浑不怕,要留清白在人间
(l)整首诗蕴含着石灰的来源、生产、性质、用途等多种化学事实,诗中所描述的变化共涉及到下列物质:①石灰石(主要成分CaC03)②Ca0③C02④H20⑤Ca(OH)2悬浊液⑥CaC03,其中属于电解质的是______(填序号)
(2)下列工业生产中一般不用石灰石作为原料的是______(填序号)
①用海水为原料生产镁 ②制硅酸盐水泥 ③制普通玻璃 ④制漂白粉⑤制陶瓷
(3)零食包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰,生石灰属于_____氧化物(填“酸性”或“碱性”),用方程式说明你的理由________.
(4)某兴趣小组同学对碳酸钙的制备进行了以下探究,该组同学使用大理石(含少量的Fe203杂质)等物质制备碳酸钙的实验流程如图:

溶解大理石时,用硝酸而不用硫酸的原因是____,“滤液A”中除H+离子外,还含有的阳离子是_____;检验该阳离予的实验操作是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴写出N2的电子式__________。下列能实现人工固氮的是__________。
A.闪电 B.在加压降温的条件下使空气中的氮气液化
C.根瘤 D.合成氨车间
⑵实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。
写出该反应的化学方程式________________________________________。
实验室制取氨气的方法有多种,下面的装置和选用的试剂中错误的是__________。

⑶氨气可使湿润的红色石蕊试纸变蓝的原因(用化学用语表示)
____________________________________________________________
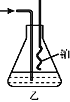
⑷用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙 装置的锥形瓶内,锥形瓶中不可能生成的物质是:__________。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
写出乙装置中氨催化氧化的化学方程式:_____________________。
⑸已知![]() ,常温常压下,在一密闭容器中将
,常温常压下,在一密闭容器中将![]() 和
和![]() 充分反应后,剩余气体的体积为__________
充分反应后,剩余气体的体积为__________ ![]() 。
。
⑹在标准状况下, ![]() 水中可溶解
水中可溶解![]() ,所得溶液的密度为
,所得溶液的密度为![]() ,则氨水的物质的量浓度为__________
,则氨水的物质的量浓度为__________ ![]() (保留一位小数)。
(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
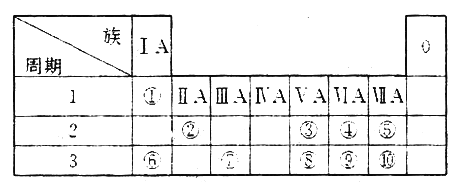
(1)⑤、⑥、⑦ 的离子半径由大到小的顺序为_________。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为_______。(用化学式表示)
(3)写出⑥在空气中加热生成的产物的电子式:_______。与⑧同族的砷(As)的原子结构示意图为_____________。
(4)⑦和⑩形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该是_______(填“共价化合物”或“离子化合物”) , 可以证明你的判断正确的实验依据是________________。
(5)表中所列元素的原子间反应最容易形成离子键的是_________(填元素符号)。⑧与⑩元素形成的常见分子中所有原子______(填“是”或“不是”)都满足最外层为8电子结构。
(6)己知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下在溶液中可发生如下两个离子反应:Ce4++Fe2+ = Fe3++Ce3+ Sn2++2Fe3+ = 2Fe2++Sn4+由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Ce3+、Fe2+ 、Sn2+ C.Sn2+、Ce3+、Fe2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com