
【题目】在同温同压下,某有机物一定条件下,与碳酸氢钠、钠均能产生气体,且生成的气体体积比(同温同压)为1:1,则此有机物可能是( )
A.HOOCCOOH B.HOCH2CH2CH2COOH
C.HOCH2CH2OH D.CH3COOH
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】CO2、CS2、COS是由C、O、S三种元素形成的结构相似的化合物。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
a.亚硫酸溶液加入Na2CO3溶液中,产生气泡
b.氧化性:浓H2SO4>H2CO3
c.CS2中碳元素为+4价,硫元素为﹣2价
d.SO2有较强还原性,而CO2无还原性
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。
①羰基硫的结构式为: 。沸点:CO2_____COS(填“大于”或“小于” ),说明原因________。
②下列有关羰基硫的推测肯定不正确的是
A.COS分子中,所有原子都满足8电子的稳定结构
B.COS分子是含有极性键的非极性分子
C.COS分子中三个原子处于同一直线上
D.COS可能在O2中燃烧
③羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下图:

已知A是一种盐,则A的化学式为 ;气体单质a为 。
(3)在恒容密闭容器中,CO和H2S混合加热生成羰基硫的反应为CO(g)+H2S(g)![]() COS(g)+H2(g),反应前CO和H2S的物质的量均为10 mol,平衡后CO的物质的量为8 mol,回答下列问题:
COS(g)+H2(g),反应前CO和H2S的物质的量均为10 mol,平衡后CO的物质的量为8 mol,回答下列问题:
①升高温度,H2S浓度增加,表明该反应是___________________反应(填“放热”或“吸热”)。
②平衡时,继续通入CO 10 mol和H2S 10 mol,一段时间后再次达到平衡,此时H2S的转化率______(填“增大”“减小”“或”“不变“)。
(4)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是
a.容器内气体密度保持不变
b.CO、H2S、COS、H2的浓度均不再变化
c.c(H2)=c(H2S)
d.υ(H2)正=υ(H2S)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式,下列判断正确的是
(i)H2(g)+ I2(g)![]() 2HI(g);△H= -9.48kJ/mol
2HI(g);△H= -9.48kJ/mol
(ii)H2(g)+ I2(s)![]() 2HI(g);△H= +26.48kJ
2HI(g);△H= +26.48kJ
A.1 mol I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol I2(s)升华,吸热17.00 kJ
![]() C.反应(i)的产物比反应(ii)的产物稳定
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型陶瓷A1N可通过反应: A12O3+N2+3C![]() 2A1N+3CO合成。下列正确的是
2A1N+3CO合成。下列正确的是
A.上述反应中,N2是还原剂,A12O3是氧化剂
B.A1N中氮元素的化合价为+3
C.上述反应中,每生成1 mol A1N需转移3 mol电子
D.A1N的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: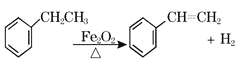 ,下列说法正确的是( )
,下列说法正确的是( )
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q、W、R、T是元素周期表短周期中的常见主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其一种同位素,可被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25,中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(1)R在元素周期表中的位置为 ;将Q、W、Z、Y的简单离子的半径从大到小排序___________________________________________(用离子符号表示)
(2)T的单质易溶于XT4中,理由是:____________________________________________。
(3)根据下表中信息,判断下列化合物固态的晶体类型(填“离子晶体”… 等):
化合物 | X3Y4 | R2T2 |
晶体类型 | ||
熔点/℃ | >3600 | -76 |
(4)任意写出一个由Y、Z元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:___________。
(5)在25℃、101 kPa下,已知13.5 g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419 kJ,写出表示W单质燃烧热的热化学方程式 。
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为 ,用化学方程式表示P2R溶液在空气中的变质过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用如图所示装置制备亚氯酸钠。

完成下列填空:
(1)装置②中产生ClO2的化学方程式为 .装置③的作用是 ;
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品.(选择合适的操作编号填空)
A.冷却到室温后,过滤
B.趁热过滤
C.常温洗涤
D.冰水洗涤
E.38~60℃的温水洗涤
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是 ;
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32﹣═2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 ___________________________。重复滴定2~3次,测得所用Na2S2O3溶液体积的平均值为20.00mL。该样品中NaClO2的质量分数为 。
(5)Na2FeO4和ClO2在水处理过程中分别被还原为Fe3+和Cl﹣.如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com