
| A. | 沸点:PH3>NH3>H2O | |
| B. | CO2分子中的化学键为非极性键 | |
| C. | NH3分子中N原子的杂化轨道类型是sp2 | |
| D. | NH4+为正四面体结构,可推测出PH4+也为正四面体结构 |
分析 A、含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高,水的沸点100℃,而氨气常温下为气体;
B、根据不同种元素形成的共价键为极性键;
C、NH3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,中心原子是以sp3杂化;
D、根据价层电子对互斥模型判断.
解答 解:A、含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高,所以沸点:PH3<NH3<H2O,故A错误;
B、二氧化碳结构为O=C=O,为极性键,故B错误;
C、NH3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,中心原子是以sp3杂化,故C错误;
D、NH4+和PH4+中,中心原子都形成4个δ键,没有孤电子对,为正四面体结构,故D正确;
故选D.
点评 本题考查较为综合,涉及元素周期律的递变规律、离子的空间结构、晶体的类型以及化合物的类型的判断,侧重于基础知识的考查,题目难度不大,注意把握元素周期律的递变规律以及元素的性质与对应单质、化合物性质的关系.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题

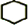 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$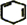 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与碱发生中和反应所放出的热量称为中和热 | |
| B. | 若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应 | |
| C. | H2→H+H的变化需要吸收能量 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过测同温同浓度下的Na2CO3和Na2SO3水溶液的pH可以确定碳和硫两元素非金属性强弱 | |
| B. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| C. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性 | |
| D. | 总质量一定时,甲醛和乙酸无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它可由PH3和HI化合而成 | |
| B. | 加热时PH4I可以分解,而且有颜色变化 | |
| C. | 它可以跟NaOH反应 | |
| D. | 它是一种共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子排布式1s22s22p63s23p64s3违反了泡利原理 | |
| B. | 基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理 | |
| C. | 根据构造原理,原子核外电子填充顺序为1s2s2p3s3p4s3d4p5s5p4d6s4f5d6p | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是氧化剂,水是还原剂 | B. | 水被还原,氯气被氧化 | ||
| C. | 氯气既是氧化剂,又是还原剂 | D. | 该反应不是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com