
【题目】四氢噻吩(![]() )是家用天然气中人工添加的气味添加剂具有相当程度的臭味。下列关于该化合物的说法正确的是
)是家用天然气中人工添加的气味添加剂具有相当程度的臭味。下列关于该化合物的说法正确的是
A. 不能在O2中燃烧B. ![]() 与Br2的加成产物只有一种
与Br2的加成产物只有一种
C. ![]() 能使酸性KMnO4溶液褪色D. 生成1 mol C4H9SH至少需要2molH2
能使酸性KMnO4溶液褪色D. 生成1 mol C4H9SH至少需要2molH2
科目:高中化学 来源: 题型:
【题目】实验室模拟侯氏制碱法原理,可以制备一些常见的化合物。
i. 30℃时,向饱和NaCl溶液中加入NH4HCO3细粉,制备NaHCO3晶体。
(1)已知30℃时几种盐的溶解度为:
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
S(g/100gH2O) | 36.3 | 27.0 | 11.1 | 41.1 |
书写化学方程式_______________________。根据反应原理结合信息解释NaHCO3易析出的原因__________________________。
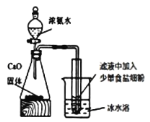
(2)过滤出NaHCO3晶体后,为继续分离滤液中的物质,设计如图装置。左侧发生装置可制取氨气,原因是_____________。一段时间后,试管中析出白色晶体为_______。用冰水浴降温目的是_____________。
ii. 制取(NH4)2SO4晶体的流程如下:
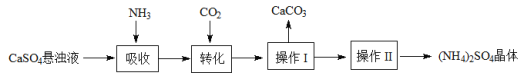
(3)“转化”步骤中CO2不宜过量,原因是__________________。
(4)操作I和II所需的实验步骤顺序是____________(选填编号,可重复选择)。
a. 蒸发浓缩 b. 蒸馏 c. 过滤 d. 萃取 e. 分液 f. 冷却结晶
(5)为测定某硫酸铵样品(杂质为碳酸铵)纯度。先准确称取5.000g样品溶于水,加入足量的_______,再加入足量BaCl2溶液充分反应后过滤、洗涤沉淀并烘干至恒重,最终所得固体为8.155g。则硫酸铵样品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸碱中和滴定实验时,盐酸为标准液,NaOH溶液为待测液,下列操作会导致待测液浓度偏大的是
A. 用碱式滴定管量取待测液时俯视刻度线(开始调液面时读数正确)
B. 未用待测液润洗锥形瓶
C. 滴定结束后俯视刻度线
D. 滴定结束后,酸式滴定管尖嘴部分有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn、Fe及其化合物在生产生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下:
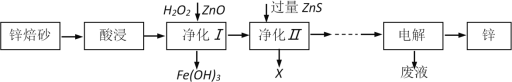
(1)为了提高酸浸效率,可采用的措施有___________________________________(任答两条);
写出ZnFe2O4溶于酸的离子方程式____________________________________
(2)向净化Ⅰ操作中加入ZnO的目的___________________________________
(3)若净化后的溶液中Cu2+浓度为1×10-12mol/L,则净化后溶液中Zn2+浓度为__________(已知:室温下Ksp(ZnS)=1.6×10-24, Ksp(CuS)=6.4×10-36)
(4)“电解”工艺制锌时Zn2+利用率较低,废液中有大 量的Zn2+ 残留。某化工厂拟采用改变酸锌比净化废液的方式来提高原料的利用率,降低成本。如图是工业生产中不同酸锌比时净化液利用率对电解时直流电耗能影响关系图。根据图分析,该工厂净化废液时的最佳酸锌比为______。
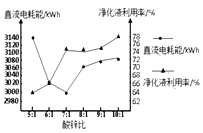
A. 5:1 B.6:1 C.7:1 D.10:1
(5)ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe2(C2O4)3·6H2O隔绝空气加热分解制备,该晶体的热分解化学方程式为_______________________________________。测热分解后产品中ZnFe2O4的质量分数方法如下:取a克产品用H2SO4溶解后加入足量KI溶液充分反应,调溶液至弱酸性,再加入淀粉指示剂,用c mol/L Na2S2O3标准溶液滴定,用去此标准溶液v mL时,刚好到达滴定终点,则此产品中ZnFe2O4的质量分数为____________(用a、c、v表示)。(已知:I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是( )
H++OH-;ΔH>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C. 向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱
D. 将水加热,pH不变,KW增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中探究二氧化氮与过氧化钠的反应。二氧化氮溶于浓硫酸(硫酸沸点为338℃),加热后NO2可逸出。(本题实验装置省略夹持仪器)
(1)制备NO2的装置如图所示:
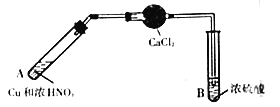
①A中发生反应的化学方程式是___________。
②干燥管内CaCl2的主要作用是吸水,吸水的主要目的是___________。
(2)加热B中吸收液,使NO2逸出,待试管充满红棕色气体后再接入装有足量Na2O2固体的试管,如图:
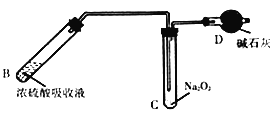
①加热B时,温度不宜过高,原因是___________。
②D中碱石灰的主要作用是___________。
(3)反应后C中固体淡黄色渐渐变白,经分析,反应产物可能有NaNO2、NaNO3,为此,进行如下实验检验:
检验NaNO2:查阅资料可知:NaNO2能使酸性KMnO4溶液褪色。检验过程如下:
取C中固体,加水溶解配制成100mL溶液,加入少量MnO2,振荡静置(记为溶液Q)。取5mL溶液Q,滴加酸性KMnO4溶液,振荡后酸性KMnO4溶液褪色。
①NaNO2使酸性KMnO4,溶液褪色的离子方程式是___________。
②加入少量MnO2的目的是除去剩余Na2O2和水反应产生的H2O2,其化学方程式为______
(4)经检验产物中还含有NaNO3。NO2与Na2O2化合生成NaNO3的化学方程式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用浓度为0.20mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。

(1)准确量取一定体积的待测液需要使用的仪器是______________。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)在生产中广泛用作催化剂、杀菌剂、脱色剂。某兴趣小组采用加热分解氯化铜晶体(CuCl2·xH2O)的方法制备CuCl,其装置如下(夹持仪器省略)。

已知:
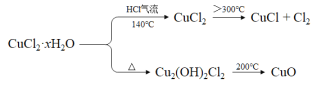
完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是___________________________。
(2)实验过程中需要全程通入干燥的HCl,其作用是___________________________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息
① 若杂质是CuCl2,则产生的原因可能是____________________________________。
② 若杂质是CuO,则产生的原因可能是_____________________________________。
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在______(填仪器名称)中充分灼烧
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至_____________________
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =________(精确到0.1)。
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的2L容器中装有2 mol N2和6mol H2,在一定条件下开始反应。2 min末测得容器中有1.2mol N2,试计算:
(1)2min末N2的浓度;__________
(2)2min内NH3的平均反应速率;__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com