
| A. | 0.1mol•L-1的NH4NO3溶液中含有的氮原子数为0.2NA | |
| B. | 1 mol氯气分别与足量铁和铝完全反应时转移的电子数均为3NA | |
| C. | 16g O2和16g O3均含有NA个氧原子 | |
| D. | 25℃时1L pH=1的H2SO4溶液中含有H+的数目为0.2NA |
分析 A、溶液体积不明确;
B、氯气和铁或铝反应后均变为-1价;
C、氧气和臭氧均由氧原子构成;
D、pH=1的硫酸溶液中,氢离子的浓度为0.1mol/L.
解答 解:A、溶液体积不明确,故溶液中氮原子的个数无法计算,故A错误;
B、氯气和铁或铝反应后均变为-1价,故1mol氯气转移2NA个电子,故B错误;
C、氧气和臭氧均由氧原子构成,故16g氧气和16g臭氧中含有的氧原子的物质的量均为1mol,个数均为NA个,故C正确;
D、pH=1的硫酸溶液中,氢离子的浓度为0.1mol/L,故1L溶液中氢原子的物质的量为0.1mol,个数为0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 化合物、原子、化合物 | B. | 有机物、单质、化合物 | ||
| C. | 无机化合物、元素、有机化合物 | D. | 化合物、原子、无机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
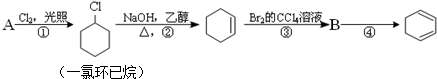
 ,①的反应类型是取代反应,③的反应类型是加成反应.反应④的化学方程式是
,①的反应类型是取代反应,③的反应类型是加成反应.反应④的化学方程式是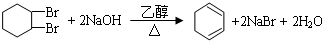
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L甲烷中含有的碳氢键数目为2NA | |
| B. | 常温下,1L 0.1mol/L的Na2CO3溶液中含有OH-离子数为0.1NA | |
| C. | 常温常压下,28 g N2、CO的混合气体中含有N2分子数为0.5NA | |
| D. | 标准状况下,22.4 L Cl2与足量NaOH溶液反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱 酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.75×10-5 | K=4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | 2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ | |
| B. | 2CN-+H2O+CO2=2HCN+CO32- | |
| C. | 中和等体积、等pH的HCN和CH3COOH消耗NaOH的量前者大于后者 | |
| D. | 等体积、等浓度的NaCN和CH3COONa溶液中所含离子总数前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
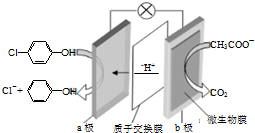 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( 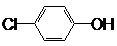 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | b为电池的正极,发生还原反应 | |
| B. | 电流从b极经导线、小灯泡流向a极+2e-+H+=Cl-+ | |
| C. | a极的电极反应式为: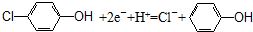 | |
| D. | 当外电路中有0.2mole-转移时,a极区增加的H+的个数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
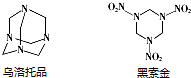 黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍.可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵和甲醛(HCHO).则反应中乌洛托品与硝酸的物质的量之比为( )
黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍.可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵和甲醛(HCHO).则反应中乌洛托品与硝酸的物质的量之比为( )| A. | 1:3 | B. | 1:4 | C. | 2:3 | D. | 2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯主要是从石油分馏中获得的一种重要化工原料 | |
| B. | 甲烷和苯都能使酸性高锰酸钾溶液褪色 | |
| C. | 石油和煤均属于化石燃料,所含元素种类不相同 | |
| D. | C3H8有两种同分异构体,C5H12有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
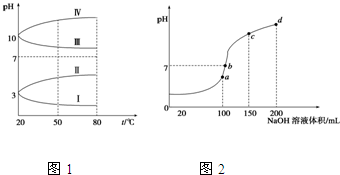
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com