
 |
 |
 |
 |
| A.配制100mL 0.1mol/L盐酸 |
B. 验证AgCl和Ag2S的溶解性 | C.测定中和反应 的反应热 |
D.实验室制取 并收集氨气 |
| A、A | B、B | C、C | D、D |


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
| A、Ag发生还原反应 |
| B、正极反应式:5MnO2+2e-=Mn5O102- |
| C、每生成1mol AgCl转移2mol电子 |
| D、Cl-不断向“水”电池的正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| AlCl3 |
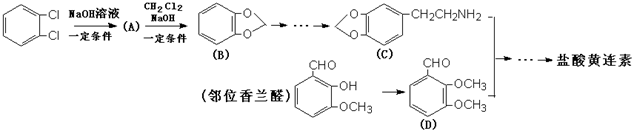
 +HCl
+HCl
 与1分子
与1分子  也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 检验方法 | 结论 |
| A | 向一种未知溶液中加入BaCl2溶液,有白色沉淀生成 | 未知溶液中一定含有SO42- |
| B | 向一种未知溶液中滴加KSCN溶液,溶液变为红色 | 未知溶液中一定含有Fe3+ |
| C | 向一种未知溶液中先加入盐酸酸化,再滴加AgNO3溶液,有白色沉淀生成 | 未知溶液中不一定含有Cl- |
| D | 向一种未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色气体 | 不能确定未知溶液中一定含有CO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
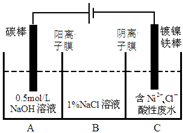 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:| A、碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O |
| B、电解过程中,B中NaCl溶液的物质的量浓度将不断减少 |
| C、为了提高Ni的产率,电解过程中需要控制废水pH |
| D、若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C、将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D、将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g的D216O中含有的中子数为9NA |
| B、物质的量浓度均为1.0mol/L的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA |
| C、33.6L NO2溶于足量的水得到的溶液中含有的NO3-数为NA |
| D、32g铜发生氧化还原反应,一定失去NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com