
| A. | CH3COOH的电离程度增大,c(H+)增大 | |
| B. | 平衡向生成CH3COOH移动,c(H+)减小 | |
| C. | CH3COOH电离程度减小,pH减小 | |
| D. | 电离平衡向生成CH3COO-、H+方向移动,pH减小 |
分析 HCl完全电离、醋酸部分电离,所以相同浓度的醋酸和盐酸中,c(H+)盐酸>醋酸,所以向相同浓度的醋酸中加入盐酸,醋酸溶液中c(H+)增大,抑制醋酸电离,据此分析解答.
解答 解:A.HCl完全电离、醋酸部分电离,所以相同浓度的醋酸和盐酸中,c(H+)盐酸>醋酸,所以向相同浓度的醋酸中加入盐酸,醋酸溶液中c(H+)增大,抑制醋酸电离,CH3COOH的电离程度减小,故A错误;
B.根据A知,c(H+)增大,平衡向生成CH3COOH移动,故B错误;
C.根据A知,c(H+)增大,CH3COOH电离程度减小,c(H+)增大,pH减小,故C正确;
D.c(H+)增大,平衡向生成CH3COOH移动,pH减小,故D错误;
故选C.
点评 本题考查弱电解质的电离,明确弱电解质电离的影响因素是解本题关键,侧重考查学生灵活运用知识分析问题能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定是非自发的化学反应,放热反应不需要加热就能发生反应 | |
| B. | 其它条件不变时,增大压强可以增大活化分子百分数,使化学反应速率加快 | |
| C. | 温度、压强一定时,熵增加的反应都能自发进行 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
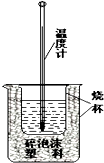 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质强 | |
| B. | 冰醋酸是弱电解质,但液态时不能导电 | |
| C. | 盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{2}$H、${\;}_{1}^{1}$H | B. | 红磷、白磷 | ||
| C. | Na2O、Na2O2 | D. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a和b可形成气态化合物 | |
| B. | c的原子半径小于d的原子半径 | |
| C. | b和c形成的化合物为离子化合物 | |
| D. | a和d最高价氧化物的水化物均呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(OH-)+c(M+)=c(H+)+c(A-) | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液和NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO${\;}_{3}^{-}$)-c(CO${\;}_{3}^{2-}$) | |
| C. | 等浓度、等体枳的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水,②10mL0.2mol/LMgCl2,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com