
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| C、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| D、铜和浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用铜片作阴、阳电极,电解稀硫酸 |
| B、用铜片作阴、阳电极,电解硫酸铜溶液 |
| C、用铜片作阳极,铁片作阴极,电解硫酸钠溶液 |
| D、用铜片、石墨、氯化钠溶液、导线等组成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
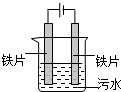 电浮选凝聚法处理污水的原理如图所示.电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体.下列说法正确的是( )
电浮选凝聚法处理污水的原理如图所示.电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体.下列说法正确的是( )| A、可以用铝片或铜片代替铁片 |
| B、阳极产生的气体可能是O2 |
| C、电解过程中H+向阳极移动 |
| D、若污水导电能力较弱,可加入足量硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列反应前后物质的总能量变化可用如图表示的是( )
下列反应前后物质的总能量变化可用如图表示的是( )| A、H-F═H+F |
| B、生石灰加水生成熟石灰 |
| C、金属钠与水反应 |
| D、HNO3+NaOH=NaNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减小容器体积,平衡不移动 |
| B、增大Y的量,Z的百分含量增大 |
| C、加入催化剂,X的转化率增大 |
| D、降低温度,正反应速率增大、逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是由一些常见元素组成的单质及其化合物之间的转化关系图.常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去).请回答下列问题:
如图是由一些常见元素组成的单质及其化合物之间的转化关系图.常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com